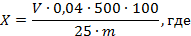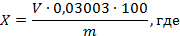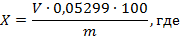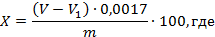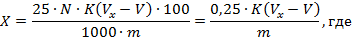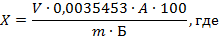- федеральная служба по ветеринарному и фитосанитарному надзору
- Правила проведения дезинфекции и дезинвазии объектов госветнадзора
- «МР 4.2.0220-20. 4.2. Методы контроля. Биологические и микробиологические факторы. Методы санитарно-бактериологического исследования микробной обсемененности объектов внешней среды. Методические рекомендации» (утв. Главным государственным санитарным врачом РФ 04.12.2020)
- 1. Общая часть
- 2. Отбор проб для исследования
- 3. Контроль качества дезинфекции помещений
- 4. Контроль качества профилактической аэрозольной дезинфекции, проводимой формалином
- 5. Контроль качества дезинфекции спецодежды
- 6. Методы определения содержания действующего вещества в дезинфицирующих средствах и их растворах
- Приложение
- 📹 Видео
Видео:Основы дезинфекцииСкачать

федеральная служба по ветеринарному и фитосанитарному надзору


 | Нормативные документы |
В данном разделе размещаются актуальные версии нормативно-правовых актов (законы, приказы, указы, решения Верховного суда РФ и др.), представляющие интерес для специалистов в области ветеринарии и фитосанитарии.
Дополнительную информацию Вы можете получить, задав вопрос в разделе «Электронная приемная».
Видео:дезинфекцияСкачать
Правила проведения дезинфекции и дезинвазии объектов госветнадзора
утверждены Минсельхозом России 15.07.2002 № 13-5-2/0525
Видео:"Дезинфекция:виды, методы и способы"Скачать

«МР 4.2.0220-20. 4.2. Методы контроля. Биологические и микробиологические факторы. Методы санитарно-бактериологического исследования микробной обсемененности объектов внешней среды. Методические рекомендации» (утв. Главным государственным санитарным врачом РФ 04.12.2020)
ГОСУДАРСТВЕННОЕ САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОЕ НОРМИРОВАНИЕ
Руководитель Федеральной службы
по надзору в сфере защиты прав
потребителей и благополучия человека,
Главный государственный санитарный
врач Российской Федерации
4 декабря 2020 г.
КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ МИКРОБНОЙ
ОБСЕМЕНЕННОСТИ ОБЪЕКТОВ ВНЕШНЕЙ СРЕДЫ
1. Разработаны ФБУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора (М.В. Зароченцев, В.В. Мордвинова, М.А. Ярославцева, А.А. Гарбузова).
2. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю. Поповой 4 декабря 2020 г.
3. МР 4.2.0220-20 введены взамен МУ 2657-82 «Методические указания по санитарно-бактериологическому контролю на предприятиях общественного питания и торговли пищевыми продуктами», утвержденные заместителем Главного государственного санитарного врача СССР 31.12.1982 N 2657.
I. ОБЩИЕ ПОЛОЖЕНИЯ И ОБЛАСТЬ ПРИМЕНЕНИЯ
1.1. Настоящие методические рекомендации (далее — МР) определяют порядок проведения санитарно-бактериологического исследования микробной обсемененности объектов внешней среды, с целью контроля микробной обсемененности и эффективности санитарной обработки инвентаря, оборудования, посуды, санитарной одежды и рук персонала.
1.2. МР предназначены для специалистов органов и организаций, осуществляющих федеральный государственный санитарно-эпидемиологический надзор, аккредитованных организаций, проводящих санитарно-эпидемиологические экспертизы, исследования и иные виды оценок, отбор проб, исследования и контроль за санитарно-гигиеническим состоянием и микробиологическими показателями.
1.3. Объектами, на которые распространяются настоящие МР, являются организации общественного питания населения, в том числе пищеблоки лечебных, детских, дошкольных и подростковых учреждений, торговые объекты и рынки, реализующие пищевую продукцию, предприятия пищевой промышленности, объекты по предоставлению гостиничных, бытовых, социальных услуг, услуг в области культуры, спорта, организации досуга, развлечений, продаже товаров производственно-технического назначения для личных и бытовых нужд.
1.4. При проведении исследований используются перечисленные в приложении 1 к настоящим МР питательные среды, реагенты и реактивы, а также аналогичные или с лучшими характеристиками.
1.5. В медицинских организациях бактериологическое исследование микробной обсемененности объектов внешней среды осуществляется в соответствии с методическими указаниями .
МУК 4.2.2942-11 «Методы санитарно-бактериологических исследований объектов окружающей среды, воздуха и контроля стерильности в лечебных организациях».
1.6. На предприятиях по производству пищевой продукции перечень микроорганизмов, не указанных в данных МР и подлежащих контролю (общее количество мезофильных аэробных и факультативно анаэробных микроорганизмов (КМАФАнМ), стафилококки, клостридии, бактерии родов Salmonella, Proteus, Listeria, Campylobacter и др.), определяется в соответствии с утвержденными в установленном порядке методическими документами и стандартами .
ГОСТ 10444.15, ГОСТ 31746, ГОСТ 29185; ГОСТ 31659; ГОСТ 28560; ГОСТ 32031; ГОСТ ISO 10272-1.
1.7. При проведении исследований микробной обсемененности объектов окружающей среды возможно применение альтернативных методов исследований, таких как использование петрифильмов, метода отпечатков (контактные экспресс-тесты, контактные чашки Родека, бактотест и др.), микробиологических анализаторов.
II. ОТБОР ПРОБ С ОБЪЕКТОВ ВНЕШНЕЙ СРЕДЫ ДЛЯ ПРОВЕДЕНИЯ
ИССЛЕДОВАНИЯ НА МИКРОБНУЮ ОБСЕМЕНЕННОСТЬ
2.1. Отбор проб с поверхностей различных объектов осуществляют методом смывов.
2.2. Для контроля микробной обсемененности и эффективности санитарной обработки смывы с объектов окружающей среды проводят до начала работы, либо во время производственного процесса после проведения надлежащей обработки поверхности. В случае необходимости выявления источника обсеменения при установленной микробной контаминации отбор производят с необработанных поверхностей.
2.3. Техника взятия смывов.
При отборе смывов с поверхности необходимо использовать стерильный тампон, увлажненный стерильной пептонной водой (пункт 1 приложения 1 к настоящим МР), внесенной в каждую пробирку в количестве не менее 2,0 мл. Допускается смачивание тампона (материала для отбора) стерильным изотоническим раствором хлорида натрия или иной допустимой транспортной средой, а также использование стерильных зонд-тампонов (свабов, тупферов и т.д.) промышленного производства. Тампон увлажняют наклонением пробирки или опусканием тампона в жидкость непосредственно перед взятием смыва.
В случае применения дезинфицирующего агента используется нейтрализатор дезинфицирующих средств. В зависимости от применяемого дезинфицирующего агента в качестве нейтрализатора допускается использование стерильных растворов химических веществ, например:
— для галоидактивных (хлор-, бром- и йодактивные) и кислородактивных (перекись водорода, ее комплексы с солями, надуксусная кислота, озон) — 0,1 — 1,0%-е растворы тиосульфата натрия;
— для четвертичных аммониевых солей (алкилдиметилбензиламмоний хлорид, дидецилдиметиламмоний хлорид и др.), аминов, производных гуанидина (полигексаметиленгуанидин гидрохлорид, хлоргексидин биглюконат и др.) — универсальный нейтрализатор, содержащий Твин 80 (3%), сапонин (0,3 — 3%), гистидин (0,1%), цистеин (0,1%);
— для альдегидов (глутаровый альдегид, глиоксаль, формальдегид, ортофталевый альдегид) — 1,0%-й раствор пиросульфита (метабисульфита) натрия или универсальный нейтрализатор (см. выше);
— для кислот — щелочи в эквивалентном количестве;
— для щелочей — кислоты в эквивалентном количестве;
— для спиртов — вода;
— для композиционных средств — универсальный нейтрализатор (см. выше). Если в состав средства входят окислители, в нейтрализатор дополнительно вводят тиосульфат натрия (0,1 — 1,0%).
Взятие смывов для предприятий, выпускающих и реализующих пищевые продукты, производится в первую очередь с зон контакта поверхности с продукцией и/или зон хвата руками для прочих объектов (приложение 2 к настоящим МР).
Рекомендации по взятию смыва:
— смывы с площади меньше или равной 10 x 10 см (100 см2) отбирают стерильным тампоном с хлопком или синтетическим материалом;
— при отборе смывов с площади более 100 см2 следует использовать салфетку (5 * 5 см);
— смывы с мелких объектов (поверхность которых менее 100 см2) берут со всей поверхности; при необходимости — с нескольких единиц одноименных предметов (вилки, ножи и т.д.);
— смывы с перчаток берут только с наружной стороны ладонной поверхности перчатки;
— при взятии смывов с рук протирают тампоном ладонные поверхности обеих рук, проводя не менее 5 раз по каждой ладони и пальцам, потом протирают межпальцевые пространства, ногти и подногтевые пространства;
— при взятии смывов с мелких инструментов обтирается вся поверхность предмета, при заборе смывов с тарелок протирают всю внутреннюю поверхность. При взятии смывов с мелких предметов одним тампоном протирают три одноименных объекта — три тарелки, три ложки и т.п. У столовых приборов протирают их рабочую часть;
— смывы с санитарной одежды отбирают с помощью тампонов с четырех участков, каждый из которых должен быть не менее 25 см2, а именно нижняя часть каждого рукава и две площадки с верхней и средней частей передних пол одежды;
— если при взятии смывов с ровной поверхности используются металлические рамки-трафареты, ограничивающие площадь взятия смывов, то такие рамки-трафареты должны быть стерильны.
При взятии смывов составляется документ, включающий в себя информацию, необходимую для однозначной идентификации объекта, места взятия, основания и условий отбора, даты и времени взятия проб, условия и сроки доставки и иные дополнительные сведения (например, техническое и санитарное состояние оборудования, инвентаря, посуды и т.п.). Документ подписывают специалист, проводивший отбор, представитель объекта, на котором производилось взятие смывов, иные заинтересованные лица.
Время доставки смывов в лабораторию не должно превышать 6 часов с момента взятия, если иное не валидировано аккредитованной лабораторией в установленном порядке, как обеспечивающее достоверный результат.
II. МЕТОД ПРОВЕДЕНИЯ ИССЛЕДОВАНИЯ МИКРОБНОЙ ОБСЕМЕНЕННОСТИ
ОБЪЕКТОВ ВНЕШНЕЙ СРЕДЫ
3.1. Бактериологическое исследование микробной обсемененности объектов внешней среды предусматривает определение бактерий группы кишечных палочек (общих колиформных бактерий, термотолерантных колиформных бактерий), S. aureus, общей бактериальной обсемененности (общего микробного числа). По эпидемиологическим показаниям номенклатура исследований микробной обсемененности объектов внешней среды может быть расширена.
3.2. Методика посева смывов на бактерии группы кишечных палочек (общие колиформные бактерии, термотолерантные колиформные бактерии).
Для выявления бактерий группы кишечных палочек (далее — БГКП) производят посевы смывов на среду Кесслер или КОДА, при этом в пробирку со средой опускают тампон и переносят 0,2 — 0,3 см3 смывной жидкости. Посевы на средах Кесслер или КОДА инкубируют при температуре (37 1) °C в течение 18 — 24 часов. После инкубации из газ-положительных пробирок со среды Кесслер производят высев на плотную дифференциальную среду Эндо, со среды КОДА высев производят только в случае изменения окраски среды или ее помутнения. Среду Эндо инкубируют при температуре (37 1) °C в течение 18 — 24 часов. Из колоний, подозрительных или типичных для БГКП, готовят мазки, окрашивают по Граму и микроскопируют либо ставят тест Грегерсена, выполняют оксидазный тест. В случае обнаружения в препаратах грамотрицательных, не образующих спор палочек дают заключение о том, что в смывах присутствуют БГКП. При отсутствии признаков роста — газообразования или изменения цвета среды — дают заключение об отсутствии в смывах БГКП.
В случае исследования на общие колиформные бактерии (далее — ОКБ) и термотолерантные колиформные бактерии (далее — ТКБ), после взятия смыва тампон помещают на 10 — 15 мин в пробирку с раствором нейтрализатора (по п. 2.3), затем переносят в пробирку с питательной средой, погрузив тампон в пептонную воду или другую допустимую смачивающую среду по п. 2.3 и инкубируют при температуре (37 1) °C в течение 18 — 24 часов. После инкубации проводят высев на среду Эндо с последующей инкубацией при температуре (37 1) °C в течение 18 — 24 часов. При наличии роста на среде Эндо, проводят исследование выросших колоний на оксидазную активность и микроскопию, окрашенного по Граму препарата, или постановку теста Грегерсена. В случае обнаружения оксидазоотрицательных и грамотрицательных палочек определяют ферментациию лактозы до кислоты и газа. Для подтверждения наличия ОКБ посев инкубируют при температуре (37 1) °C в течение 48 часов, для подтверждения наличия ТКБ посев осуществляют в среду, предварительно прогретую до температуры (43 — 44) °C, и инкубируют при температуре (44 0,5) °C в течение 24 часов. При обнаружении кислоты и газа дают положительный ответ.
3.3. Методика посева на общую бактериальную обсемененность (общее микробное число).
Для определения общей бактериальной обсемененности (общего микробного числа) поверхностей 1,0 см3 смывной жидкости помещают в чашку Петри и заливают расплавленным питательным агаром. Чашки помещают в термостат при температуре (30 1) °C. Предварительный подсчет выросших колоний производят через 48 часов, окончательный — через 72 часа. Количество колоний, выросших на чашке, умножают на 10 для определения общего количества бактерий, содержащихся на поверхности исследуемого предмета.
3.4. Методика посева на S. aureus.
Для выявления S. aureus делают высев 0,2 — 0,3 см3 смывной жидкости в пробирку с 5,0 см3 6,5% солевого бульона. Засеянные пробирки инкубируют при при температуре (37 1) °C в течение 18 — 24 часов, после чего делают высев на одну из агаризованных селективно-диагностических сред: молочно-солевой агар (МСА), стафилококкагар, манитолагар, агар Байд-Паркер, яично-желточно-азидный агар, желточно-солевой агар (ЖСА) или другие питательные среды, предназначенные для роста стафилококков, разрешенных к применению в установленном порядке. Чашки с посевами инкубируют при температуре (37 1) °C в течение 18 — 48 часов.
Для подтверждения принадлежности колоний к S. aureus подозрительные колонии отсевают на скошенный в пробирке питательный агар для дальнейшего исследования. Инкубируют при температуре (37 1) °C в течение 18 — 24 часов.
После инкубации у выделенных штаммов проверяют морфологию, тинкториальные свойства (окраска по Граму или тест Грегерсена) и наличие плазмокоагулирующей активности в реакции плазмокоагуляции (РПК).
Идентификация и подтверждение видовой принадлежности S. aureus возможна с применением биохимической лабораторной идентификации, коммерческих тест-системы идентификации, методов иммуноферментного анализа, разделенного импеданса, масспектрометрии или микробиологических анализаторов в соответствии с действующими методическими документами и инструкциями производителей.
3.5. При проведении исследований объектов внешней допускается использование готовых и дегидратированных питательных сред, в том числе хромогенных, зарегистрированных в установленном порядке.
IV. ПРИНЦИПЫ ОЦЕНКИ РЕЗУЛЬТАТОВ
4.1. Критерием удовлетворительного качества санитарной обработки оборудования, посуды, инвентаря и др. служит отсутствие на поверхности обработанных предметов санитарно-показательных, условно-патогенных, а также патогенных микроорганизмов.
Видео:ВЕБИНАР. Контроль качества дезинфекционно-стерилизационных мероприятийСкачать

1. Общая часть
1.1. Настоящие методические указания определяют порядок и методы контроля качества профилактической и вынужденной (текущей и заключительной) дезинфекции объектов, подлежащих ветеринарному надзору.
1.2. Методические указания предназначены для специалистов ветеринарных лабораторий, а также лабораторий хозяйств, ДПС и предприятий по производству и переработке мяса и сырья животного происхождения.
1.3. Контроль качества проводят в три этапа.
1.3.1. Контроль подготовки объектов к дезинфекции (проверяют степень очистки поверхностей, их увлажненность, защиту электрооборудования и приборов, герметизацию помещений) осуществляет ветеринарный специалист, ответственный за проведение дезинфекции.
1.3.2. Контроль за соблюдением установленных режимов дезинфекции (выбор препарата и метода дезинфекции, концентрация, температура раствора, равномерность увлажнения поверхностей дезраствором, соблюдение параметров производительности используемых машин и аппаратов, качество распыла раствора) осуществляет ветеринарный специалист, ответственный за выполнение дезинфекции.
1.3.3. Бактериологический контроль качества дезинфекции осуществляют специалисты ветеринарных лабораторий периодически или в сроки, установленные с учетом эпизоотической обстановки, технологии производства, целей дезинфекции и других конкретных особенностей.
1.3.3.1. Бактериологический контроль качества дезинфекции должен быть неожиданным, без предварительного уведомления работников, ответственных за проведение дезинфекции, и исполнителей этих работ о времени и месте отбора проб для исследования.
1.3.3.2. При бактериологическом контроле качества дезинфекции определяют наличие на поверхностях обеззараживаемых объектов жизнеспособных клеток санитарно-показательных микроорганизмов — бактерий группы кишечной палочки (Eschezichia, Citrobacter, Enterobacter), стафилококков (aureus, epidermatis, Saprophiticus), микобактерий или спорообразующих аэробов рода Bacillus.
Качество обеззараживания спецодежды контролируют по выделению тестмикроорганизмов из искусственно контаминированных кусочков тканей, закладываемых в подлежащий обеззараживанию материал.
1.3.3.3. По наличию или отсутствию бактерий группы кишечной палочки контролируют качество профилактической дезинфекции, вынужденной (текущей и заключительной) дезинфекции при бруцеллезе, колибактериозе, лептоспирозе, листериозе, болезни Ауески, лейкозе, пастереллезе, сальмонеллезах, трихомонозе, кампилобактериозе, трипанозомозах, токсоплазмозе, инфекционном ринотрахеите, парагриппе и вирусной диарее крупного рогатого скота, контагиозной эктиме, инфекционной агалактии и контагиозной плевропневмонии овец и коз, отечной болезни, инфекционном атрофическом рините, дизентерии, трансмиссивном гастроэнтерите, балантидиозе, гемофилезной плевропневмонии и роже свиней, ринопневмонии лошадей, пуллорозе-тифе птиц, миксоматозе кроликов, микоплазмозе птиц, а также текущей дезинфекции при болезнях, указанных в п. 1.3.3.4. (кроме туберкулеза, споровых и экзотических инфекций).
1.3.3.4. По наличию или отсутствию стафилококков контролируют качество текущей дезинфекции при туберкулезе, болезнях, вызываемых спорообразующими микроорганизмами и экзотических инфекциях; заключительной дезинфекции при туберкулезе, аденовирусных инфекциях, ящуре, оспе, туляремии, орнитозе (пситтакозе), диплококкозе, стафилококкозе, стрептококкозе, некробактериозе, катаральной лихорадке, бешенстве, чуме всех видов животных, злокачественной катаральной горячке, перипневмонии и паратуберкулезном энтерите крупного рогатого скота, инфекционной катаральной лихорадке, копытной гнили и инфекционном мастите овец, везикулярной болезни свиней, инфекционной анемии, инфекционном энцефаломиелите, эпизоотическом лимфангоите, сапе и мыте лошадей, гепатите утят, вирусном энтерите гусят, инфекционном бронхите, ларинготрахетие, болезни Марека, болезни Гамборо, инфекционном энцефаломиелите, Ньюкаслской болезни, вирусном энтерите, алеутской болезни, псевдомонозе и инфекционном гепатите плотоядных, хламидиозах, риккетсиозах, энтеровирусных инфекциях, гриппе сельскохозяйственных животных и птиц, трихофитии, микроспории, других микозах животных и птиц, актиномикозе крупного рогатого скота, а также болезнях, вызываемых неклассифицированными вирусами.
Качество заключительной дезинфекции при микозах контролируют также по выделению соответствующих возбудителей.
1.3.3.5. Качество заключительной дезинфекции при туберкулезе контролируют по выделению стафилококков и микобактерий, при сибирской язве, эмфизематозном карбункуле, брадзоте, злокачественном отеке, других споровых инфекциях и экзотических инфекциях — по наличию или отсутствию спорообразующих микроорганизмов рода Bacillus.
Видео:Индикаторы и методы контроля стерилизацииСкачать

2. Отбор проб для исследования
2.1. Отбор проб для бактериологического контроля и доставку их в лабораторию осуществляют лица, не несущие личной ответственности за качество дезинфекции и не находящиеся в подчинении работников, ответственных за ее проведение.
2.2. Отбор проб проводят по истечении срока экспозиции, указанной в соответствующих разделах действующих инструкций, до начала проветривания помещений; при дезинфекции спецодежды — по окончании цикла обработки (обеззараживания, стирки, ополаскивания и отжима).
2.3. Пробы (смывы, отпечатки, соскобы) для исследования берут с 10 — 20 различных участков поверхности животноводческого помещения (полов, стойл и проходов, стен, перегородок, столбов, кормушек, поилок и т.д.). При наличии на объекте участков поверхности с механическими загрязнениями, пробы материала для исследования берут методом соскобов.
При контроле качества дезинфекции других объектов ветеринарного надзора пробы берут с 10 — 20 различных участков поверхностей каждого помещения, выбирая наименее доступные для дезинфекции.
2.3.1. Для контроля качества дезинфекции при туберкулезе с каждого вида поверхности берут по 5 смывов, которые объединяют в одну пробу. Из каждого помещения отбирают не менее 10 объединенных проб, в т.ч. по 3 пробы с пола и кормушек.
При заключительной дезинфекции одновременно берут пробы с территории фермы в разных направлениях от углов здания и от центра каждой стены на расстоянии 5, 10 и 15 м (с учетом рельефа местности). Всего с прилегающей территории отбирают не менее 24 проб. Поверхностный слой грунта разрыхляют стерильным скальпелем или ножом на глубину до 3 — 5 см и отбирают в стерильную посуду 10 — 20 г исследуемого материала. Если прилегающая территория имеет твердое покрытие, пробы отбирают методом смывов, как указано выше.
2.4. После проведения дезинфекции и последующей экспозиции с участков, подвергаемых контролю, отбирают пробы стерильными ватно-марлевыми тампонами, смоченными в стерильном нейтрализующем растворе или воде (см. приложение п. 2).
Участки площадью 10×10 см, тщательно протирают до полного снятия с поверхности всех имеющихся на ней загрязнений. После чего тампоны помещают в пробирку с нейтрализующей жидкостью.
Плотные загрязнения (корочки) снимают с помощью стерильного скальпеля и переносят в эту же пробирку.
2.5. Для нейтрализации действия дезинфицирующих средств готовят специальные растворы в концентрации в 10 раз меньшей, чем концентрация применяемого дезинфектанта (см. приложение п. 1).
Для нейтрализации хлоросодержащих дезинфицирующих средств используют раствор тиосульфата натрия (гипосульфита), щелочных растворов — раствор уксусной кислоты; формалина — раствор аммиака (нашатырный спирт); кислот, перекиси водорода и ее производных — раствор бикарбоната натрия.
При использовании для дезинфекции щелочного раствора формальдегида, участки сначала увлажняют раствором аммиака, затем дополнительно раствором уксусной кислоты.
При дезинфекции дезонолом, лизолом, феносмолином, фенолятом натрия и другими средствами, для которых нет нейтрализаторов, применяют стерильную водопроводную воду.
2.6. Взятие отпечатков на тонкий слой плотной питательной среды проводят лица, прошедшие подготовку по данному вопросу.
Предметные стекла с нанесенной средой (см. приложение п. 3) извлекают корнцангом из ванн или пробирок, не касаясь застывшей питательной среды, и накладывают на исследуемый объект таким образом, чтобы питательная среда соприкасалась с его поверхностью. Через 2 мин. пробы-отпечатки отделяют от контролируемого объекта и помещают в ванны или пробирки, в которых они транспортировались. При взятии проб с труднодоступных или вертикальных поверхностей время контакта слоя питательной среды с объектом сокращают до 30 с.
2.7. Смывы должны быть доставлены в лабораторию в течение 3 — 6 ч с момента взятия, отпечатка — не позднее 2 ч.
Видео:Вебинар 1. Внутрилабораторный контроль качества.Скачать
3. Контроль качества дезинфекции помещений
3.1. Метод бактериологического исследования смывов.
3.1.1. Пробы, каждую в отдельности, отмывают в той же пробирке путем нескольких погружений и отжатий тампона.
Отжатые тампоны удаляют, а жидкость центрифугируют при 3000 — 3500 об/мин в течение 20 — 30 мин. Затем надосадочную жидкость сливают, в пробирку наливают такое же количество стерильной воды, содержимое смешивают и снова центрифугируют. Надосадочную жидкость сливают, а из центрифугата делают посевы.
При наличии в смыве грубых механических примесей их растирают в пробирке стеклянной палочкой, после чего смыв переносят в центрифужную пробирку.
3.1.2. Для индикации кишечной палочки 0,5 мл центрифугата высевают в пробирки с модифицированной средой Хейфеца или КОДА (см. приложение п. 5.1.). Посевы выдерживают в термостате при температуре 37 — 38 °С в течение 12 — 18 ч. Изменение сиренево-красного цвета среды в зеленый или салатовый цвет с помутнением сред и газообразованием свидетельствует о наличии роста кишечной палочки.
Другие изменения цвета ( желтоватый, розовый, сероватый), наблюдаемые при росте микроорганизмов других видов, не учитывают.
В сомнительных случаях делают подтверждающий посев с жидких сред на агар Эндо. Посевы инкубируют при температуре 37 — 38 °С в течение 12 — 16 ч.
3.1.3. Для индикации стафилококков 0,5 мл центрифугата высевают в 5 мл мясопептонного бульона с 6,5 % хлористого натрия. Через 22 — 24 ч инкубирования посевов при температуре 37 — 38 °С делают пересевы бактериологической петлей на 8,5 %-ный солевой мясопептонный агар. Посевы выдерживают в термостате 22 — 24 ч при температуре 37 — 38 °С. Из выросших культур для подтверждения роста стафилококков готовят мазки, окрашивают их простым методом и микроскопируют.
3.1.4. Для индикации спорообразующих аэробов смывы обрабатывают как указано в пп. 3.1.1., но перед центрифугированием их прогревают на водяной бане при 65 °С в течение 30 мин, затем центрифугируют. Из центрифугата каждой пробы делают посевы в одну пробирку с МПБ и на 2 чашки с МПА (для контроля качества дезинфекции при сибирской язве МПА может быть заменен дифференциально-диагностической средой — см. приложение п. 5.3). Посевы инкубируют в термостате при 37 °С в течение 24 — 48 ч.
При наличии роста на МПА подсчитывают количество колоний, а также изучают их морфологию при малом увеличении микроскопа. В случае возникновения подозрения на выделение возбудителя сибирской язвы, идентификацию такой культуры проводят в порядке, предусмотренном действующими Методическими указаниями по данному вопросу.
При наличии роста на дифференциально-диагностической среде в крышку чашки Петри вносят 1 — 2 мл 25 %-ного водного раствора аммиака, чашку (крышкой вниз) выдерживают при 20 ± 2 °С в течение 1 мин, после чего визуально или под малым увеличением микроскопа проводят учет теста.
Под действием паров аммиака происходит порозовение колоний микроорганизмов, обладающих фосфатазной активностью.
Вас. anthracis фосфатазной активностью не обладает и его колонии остаются бесцветными.
При отсутствии роста или характерных колоний на плотных средах и наличии роста в МПБ, делают дробные посевы из МПБ на плотную питательную среду, с которыми поступают как указано выше.
3.1.5. При просмотре посевов учитывают общее количество проб, в которых обнаружен рост санитарно-показательных микроорганизмов, а при споровой инфекции — и количество колоний непатогенных споро-образующих аэробов рода Bacillus.
3.2. Метод отпечатков на тонкий слой плотной питательной среды.
3.2.1. Метод отпечатков является ускоренным методом выделения санитарно-показательных микроорганизмов с поверхностей животноводческих объектов и наиболее приемлем в условиях промышленного ведения животноводства на комплексах, птицефабриках и других объектах, где имеются лаборатории.
3.2.2. Ванны и пробирки с пробами-отпечатками, доставленные в лабораторию, помещают в термостате при температуре 37 °С на 16 — 18 ч.
3.2.3. После инкубирования пробы просматривают невооруженным глазом на наличие роста.
При отсутствии макроколоний и изменения среды пробы дальнейшим исследованиям не подвергают. В сомнительных случаях, когда отсутствует рост макроколоний, но произошло изменение цвета или прозрачности среды, пробы-отпечатки высушивают на воздухе до полного подсыхания среды, фиксируют над пламенем, окрашивают по Муромцеву и микроскопируют с целью обнаружения микроколоний.
3.2.4. Учитывают общее количество отпечатков, в которых обнаружен рост микроорганизмов.
3.3. Исследование с целью выделения микобактерий.
3.3.1. Контроль качества заключительной дезинфекции при туберкулезе проводят параллельно двумя методами по выделению стафилококка и микобактерий.
3.3.2. Смывы обрабатывают как указано в пп. 3.1.1. Из центрифугата каждой объединенной пробы делают высев на среды для выделения стафилококков, с которыми поступают как указано в пп. 3.1.3., и готовят по 6 мазков на узких (1,2×7,5 см) предметных стеклах (см. приложение п. 4). Мазки высушивают при комнатной температуре или в термостате в течение 2 — 3 ч., складывают их по два тыльной стороной и погружают в 8 — 12 %-ный раствор серной кислоты на 15 мин. После этого стекла-мазки берут пинцетом и погружают на 5 — 10 секунд в стерильную дистиллированную воду, а затем переносят в пробирки со средой Сотона и помещают в термостат при 37 — 38 °С на 12 суток.
3.3.3. Пробы почвы с прилегающей территории и соскобов с поверхности помещений, каждую в отдельности, помещают в колбу, заливают 2 — 3-кратным количеством дистиллированной воды, взбалтывают и фильтруют через двойной слой марли в узкогорлую колбу емкостью 200 — 250 мл. К фильтрату добавляют 2 — 3 мл ксилола или авиационного бензина, встряхивают 15 — 20 мин и доливают дистиллированной воды до горлышка. Содержимое отстаивают 30 мин с целью получения флотата, из которого готовят мазки на узких предметных стеклах. В дальнейшем с мазками поступают как указано в пп. 3.3.2.
3.3.4. При наличии роста стафилококков хотя бы в одной исследованной пробе качество дезинфекции признают неудовлетворительным и дальнейшее исследование по выделению микобактерий не проводят.
3.3.5. Стекла с мазками извлекают из пробирок на 6, 8, 12 день инкубирования, высушивают, фиксируют над пламенем горелки, окрашивают по Циль-Нильсену и микроскопируют для обнаружения микроколоний.
3.4. Оценка результатов исследования.
3.4.1. Качество профилактической дезинфекции помещений для получения и содержания молодняка животных (птицы) и текущей дезинфекции изолированных секций (боксов, скотных дворов) с автономной системой жизнеобеспечения животных признают удовлетворительным при отсутствии роста санитарно-показательных микроорганизмов в 90 % исследованных проб.
При профилактической дезинфекции помещений для содержания взрослого поголовья и текущей дезинфекции частично освобожденных от животных или неизолированных помещений допускается выделение санитарно-показательных микроорганизмов из 20 % исследованных проб.
3.4.2. Качество заключительной дезинфекции при ее контроле по выделению бактерий группы кишечной палочки, стафилококков, грибов и микобактерий признают удовлетворительным при отсутствии выделения названных культур во всех исследованных пробах.
При споровых инфекциях качество дезинфекции признают удовлетворительным при отсутствии роста Вас. anthracis при этом допускают рост в прямом посеве на МПА единичных (не более трех в смыве) колоний непатогенных спорообразующих аэробов рода Bacillus.
Видео:Новые подходы к внутреннему контролю качества и безопасности медицинской деятельности (ВККиБ МД)Скачать

4. Контроль качества профилактической аэрозольной дезинфекции, проводимой формалином
4.1. Настоящая методика предназначена для быстрого (непосредственно после окончания экспозиции дезинфекции) контроля качества аэрозольной дезинфекции животноводческих помещений, проводимой формалином.
4.2. Метод основан на окрашивании индикаторной среды под воздействием газовой и капельной фаз аэрозоля формальдегида. В качестве индикаторной среды используют среду Эндо, которая под воздействием формальдегида в процессе аэрозольной дезинфекции приобретает резко очерченное красное окрашивание.
4.3. Перед проведением дезинфекции индикаторные пробирки (см. приложение п. 6) размещают на полу, стенах и потолке помещения и находящемся в помещении оборудовании. Особо важно разместить пробирки в труднодоступных местах помещения: (внутри оборудования, у щелей и т.д.). На одно помещение требуется в среднем 10 — 15 пробирок. Индикаторные пробирки прикрепляют к поверхностям помещения с помощью пластилина, липкой ленты или других средств.
Перед размещением пробирок с последних снимают парафиновые колпачки. На полу помещения пробирки устанавливают открытым концом вверх, на стенах — срез пробирки должен находиться в вертикальной плоскости, на потолке — открытым концом вниз.
4.4. Оценку качества дезинфекции проводят непосредственно после окончания экспозиции (12 или 24 ч). Линейкой с миллиметровой шкалой измеряют длину окрашенного столбика индикаторной среды, начиная с обреза пробирки. Дезинфекция считается удовлетворительной, если глубина окрашивания среды после экспозиции 12 ч будет не меньше 18 мм, а после экспозиции 24 ч — 30 мм.
Видео:Контроль качества продукции ➤ Что это и как организовать?Скачать

5. Контроль качества дезинфекции спецодежды
5.1. Качество дезинфекции спецодежды, мешкотары и прочих изделий из тканевых материалов, подвергаемых обеззараживанию в камерах, методом замачивания в дезинфицирующем растворе, кипячением или по режимам одновременной стирки и дезинфекции, контролируют по выделению тест-культур микроорганизмов из тест-объектов, закладываемых в подлежащий обеззараживанию материал.
5.2. При контроле качества дезинфекции в очагах бактериальных (кроме туберкулеза) и вирусных инфекций в качестве тест-культуры используют музейные штаммы кишечной палочки, в очагах туберкулеза и мало изученных вирусных инфекций — золотистого стафилококка, в очагах споровых инфекций — антракоида.
5.3. В качестве тест-объектов используют кусочки батистовой ткани, импрегнированные соответствующей тест-культурой (см. приложение п. 7).
5.4. Тест-объекты закладывают по 2 шт. в стерильные мешочки размером 5×8 см, изготовленные в виде конверта из той же ткани, что и подлежащие обеззараживанию изделия, мешочки с вложенными в них тест-объектами помещают в карман спецодежды или пришивают нитками к подлежащим обеззараживанию изделиям.
При дезинфекции методом замачивания в дезрастворах или кипячения изделия с заложенными в них тест-объектами размещают послойно (внизу, в середине и в верхней части емкости), а при дезинфекции в камерах — в разных местах камеры.
5.5. По истечении экспозиции дезинфекции или цикла «стирка-отполаскивание-отжим» при использовании метода одновременного обеззараживания и стирки мешочки с тест-объектами извлекают, помещают в стерильные чашки Петри и доставляют в лабораторию для исследования.
В лаборатории тест-объекты извлекают из мешочков, промывают по 5 мин в растворе соответствующего нейтрализатора (см. п. 2.5) и стерильной водопроводной воде (или дважды в воде, если нейтрализатор не известен), и помещают каждый в отдельности в пробирки с соответствующими питательными средами. Если дезинфекцию проводили методом кипячения без добавления кальцинированной соды, дополнительного промывания тест-объектов не требуется.
5.6. При контроле качества дезинфекции по выделению кишечной палочки посев проводят в модифицированную среду Хейфеца или КОДА, для выделения золотистого стафилококка — в 6,5 %-ный солевой МПБ, для выделения антракоида — в МПБ, с которыми поступают как указано в пп. 3.1.2 — 3.1.4.
5.7. Качество дезинфекции признают удовлетворительным при отсутствии роста тест-культуры во всех пробах.
Видео:Контроль качества и обеспечение качества при проведении клинических исследованийСкачать

6. Методы определения содержания действующего вещества в дезинфицирующих средствах и их растворах
6.1. Определение массовой доли едкого натра в препарате и его растворах.
6.1.1. Аппаратура, реактивы и растворы.
Весы лабораторные общего назначения по ГОСТ 24104-80 с наибольшим пределом взвешивания 500 г, 3-го класса точности.
Колба по ГОСТ 1770-74, исполнения 1 или 3, вместимостью 500 см 3 .
Пипетка по ГОСТ 20292-74, вместимостью 20, 25 см 3 .
Бюретка по ГОСТ 20292-74, вместимостью 50 см 3 с ценой деления 0,1 см 3 .
Кислота соляная по ГОСТ 3118-77, х.ч. или ч.д.а. раствор (HCl) = 1 моль/дм 3 .
Барий хлористый по ГОСТ 4108-72, х.ч. или ч.д.а., 10 %-ный раствор, предварительно нейтрализованный по фенолфталеину.
Фенолфталеин по ГОСТ 5850-72, 1 %-ный спиртовой раствор.
6.1.2. Подготовка к анализу.
6.1.2.1. Приготовление анализируемого раствора твердого препарата.
Перед взятием навески с пробы препарата удаляют верхний выветрившийся слой, в стаканчик для взвешивания быстро отбирают около 20 г препарата и взвешивают. Навеску количественно переносят в мерную колбу, приливают 300 — 400 см 3 воды, растворяют, охлаждают, доводят объем раствора водой до метки и перемешивают — раствор А.
6.1.2.2. Приготовление анализируемого раствора жидкого препарата.
25 см 3 препарата отбирают в предварительно взвешенный стакан вместимостью 100 см 3 , взвешивают, количественно переносят в мерную колбу, разбавляют водой до метки и перемешивают — раствор Б.
Растворы А и Б готовят из двух параллельных навесок.
6.1.3. Проведение анализа.
25 см 3 раствора А и Б помещают в коническую колбу вместимостью 250 см 3 , добавляют 20 см 3 раствора хлористого бария, перемешивают и закрывают пробкой. Через 5 мин вводят 2 — 3 капли раствора фенолфталеина и титруют раствором соляной кислоты концентрации 1 моль/дм 3 до обесцвечивания индикатора.
6.1.4. Обработка результатов.
Массовую долю едкого натра (X) в процентах вычисляют по формуле
V — объем раствора соляной кислоты концентрации 1 моль/дм 3 , израсходованный на титрование, см 3 ;
m — масса навески, взятой для приготовления растворов А или Б, г;
0,04 — масса едкого натра, соответствующая 1 см 3 раствора соляной кислоты концентрации точно 1 моль/дм 3 , г.
За результат анализа принимают среднее арифметическое двух параллельных определений, допускаемые расхождения между которыми не должны превышать 0,2 % при доверительной вероятности Р = 0,95.
6.2. Определение содержания формальдегида в формалине техническом, параформе и их растворах.
6.2.1. Реактивы и растворы.
Кислота соляная по ГОСТ 3118-77, ч.д.а., или кислота серная по ГОСТ 4204-77, ч.д.а., растворы концентрации 1 и 0,1 моль/дм 3 ;
Натрия гидроокись по ГОСТ 4328-77, ч.д.а., раствор концентрации 0,1 моль/дм 3 .
Натрий сернокислый (сульфит натрия) по ГОСТ 195-77 или ГОСТ 429-76, ч.д.а., раствор, 126 г безводного сульфита натрия или 252 г кристаллического растворяют в воде в мерной колбе вместимостью 1 дм 3 с последующим тщательным перемешиванием;
Вода дистиллированная по ГОСТ 6709-72.
6.2.2. Проведение анализа.
1,5 — 1,8 г формалина или 0,5 — 0,6 г параформа взвешивают в колбе с пробкой, содержащей 10 см 3 дистиллированной воды, результат взвешивания в граммах записывают до четвертого десятичного знака. При определении содержания формальдегида в рабочих растворах формалина или параформа для исследования берут 5 — 25 см 3 в зависимости от предполагаемой концентрации. К полученному раствору прибавляют две капли тимолфталеина и нейтрализуют раствором гидроокиси натрия до бледно-голубой окраски.
В другую колбу помещают 50 см 3 раствора сульфита натрия, добавляют две капли тимолфталеина и нейтрализуют раствором соляной или серной кислоты концентрации 0,1 моль/дм 3 до исчезновения голубой окраски или раствором гидроокиси натрия до появления бледно-голубой окраски.
Нейтральный раствор сульфита натрия переливают в колбу с навеской, перемешивают в течение 2 мин и титруют раствором соляной или серной кислоты концентрации 1 моль/дм 3 до исчезновения голубой окраски.
6.2.3. Обработка результатов.
Массовую долю формальдегида (X) в процентах вычисляют по формуле:
V — объем раствора соляной или серной кислоты концентрации точно 1 моль/дм 3 , израсходованный на титрование, см 3 ;
0,03003 — масса формальдегида, соответствующая 1 см 3 раствора соляной или серной кислоты концентрации точно 1 моль/дм 3 , г;
m — масса анализируемой пробы, г.
За результат анализа принимают среднее арифметическое двух параллельных определений, допускаемые расхождения между которыми не должны превышать 0,2 % при доверительной вероятности Р = 0,95.
Результат округляют до первого десятичного знака.
6.3. Определение массовой доли углекислого натрия в кальцинированной соде технической.
6.3.1. Реактивы и растворы.
Кислота серная по ГОСТ 4204-77, раствор с (1/2 H2SO4 = 1 моль/дм 3 )
Метиловый оранжевый (индикатор), 0,1 %-ный водный раствор.
Вода дистиллированная по ГОСТ 6709-72.
6.3.2. Проведение анализа.
Взвешивают от 2,3 до 2,5 г кальцинированной соды прокаленной при 270 — 300 °С до постоянной массы, помещают в коническую колбу вместимостью 250 см 3 , растворяют в 20 см 3 воды и титруют раствором серной кислоты в присутствии метилового оранжевого до изменения окраски раствора из желтой в оранжево-розовую.
6.3.3. Обработка результатов.
Массовую долю углекислого натрия (X) в процентах вычисляют по формуле:
V — объем раствора серной кислоты концентрации точно 1 моль/дм 3 , израсходованный на титрование, см 3 ;
0,05299 — масса углекислого натрия, соответствующая 1 см 3 раствора серной кислоты концентрации точно с (1/2 H2SO4 = 1 моль/дм 3 , г/см 3 );
m — масса навески кальцинированной соды, г.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, допускаемые расхождения между которыми не должны превышать 0,2 %.
6.4. Определение массовой доли перекиси водорода в препарате и его растворах.
6.4.1. Реактивы и растворы.
Калий марганцовокислый по ГОСТ 20490-76, х.ч., 0,1 н. раствор.
Кислота серная по ГОСТ 4204-77, х.ч., раствор 1:4.
Вода дистиллированная по ГОСТ 6709-72.
6.4.2. Проведение анализа.
0,15 — 0,20 г перекиси водорода или 1,0 — 2,0 мл рабочего раствора, взятые с погрешностью не более 0,0002 г (или 0,01 мл), помещают в коническую колбу вместимостью 250 см 3 . Вносят 25 см 3 воды, 20 см 3 серной кислоты и титруют раствором марганцовокислого калия до розовой окраски, не исчезающей в течение минуты.
Одновременно проводят контрольный опыт в тех же условиях и с тем же количеством реактивов, но без анализируемого препарата.
6.4.3. Обработка результатов.
Массовую долю перекиси водорода (X) в процентах вычисляют по формуле:
V — объем точно 0,1 н. раствора марганцовокислого калия, израсходованный на титрование анализируемого раствора, см 3 ;
V1 — объем точно 0,1 н. раствора марганцовокислого калия, израсходованный на титрование контрольного опыта, см 3 ;
0,0017 — масса перекиси водорода, соответствующая 1 см 3 точно 0,1 н. раствора марганцовокислого калия, г;
m — масса навески (г), или объем раствора (мл) взятых для анализа.
За результат анализа принимают среднее арифметическое двух параллельных определений, допускаемые расхождения между которыми не должны превышать 0,1 %.
6.5. Определение массовой доли глутарового альдегида в препарате и его растворах.
6.5.1. Реактивы и растворы.
Йод по ГОСТ 4159-79, 0,1 н. раствор;
Вода дистиллированная по ГОСТ 6709-72;
Раствор бисульфита натрия (NaHSO3) — готовят растворением в воде пиросульфита натрия из расчета 4,0 г Na2S2O5 на 1 дм 3 воды. Взвешивают пиросульфит натрия и растворяют его в дистиллированной воде при тщательном перемешивании. Хранят в посуде, плотно закрытой пробкой.
6.5.2. Проведение анализа.
В 3 конические колбы вносят мерной пипеткой по 25 см 3 раствора бисульфита натрия, закрывают их притертыми пробками. Затем в колбы с бисульфитом натрия вносят пробы анализируемого раствора глутарового альдегида (содержащие около 0,025 г глутарового альдегида), взвешенные на аналитических весах с погрешностью не более 0,0002 г. Колбы оставляют при комнатной температуре на 30 мин, после чего оттитровывают непрореагировавший бисульфит натрия 0,1 н раствором йода до появления желтой окраски раствора.
Параллельно с рабочим проводят контрольный опыт, для чего в три конические колбы вносят по 25 см 3 раствора бисульфита натрия и оттитровывают их 0,1 н раствором йода до появления желтого окрашивания. Ввиду большой смачиваемости стенок бюретки раствором йода во избежание большой ошибки титрование ведут при одинаковой скорости истечения раствора йода во время рабочего и контрольного определений.
6.5.3. Обработка результатов анализа.
Массовую долю глутарового альдегида определяют по формуле:
X — массовая доля глутарового альдегида, %;
m — навеска раствора глутарового альдегида, г;
N — нормальность водного раствора йода;
K — поправочный коэффициент к титру раствора йода;
Vx — объем раствора йода, пошедший на титрование 25 см 3 раствора бисульфита натрия (контрольной пробы), см 3 ;
V — объем раствора йода, пошедший на титрование рабочей пробы, см 3 .
За результат анализа принимают среднее арифметическое трех определений, расхождение между максимальным и минимальным значениями которых не должно превышать 3 %.
6.6. Определение массовой доли активного хлора в препаратах и их растворах.
6.6.1. Реактивы и растворы.
Вода дистиллированная по ГОСТ 6709-72.
Калий йодистый по ГОСТ 4232-74, 10 %-ный раствор.
Кислота серная по ГОСТ 4204-77, 5 %-ный раствор.
Крахмал растворимый по ГОСТ 10163-76, 1 %-ный раствор.
6.6.2. Определение массовой доли активного хлора в хлорной извести, кальция гипохлорите нейтральном и натриевой соли дихлоризоциануровой кислоты.
1 — 1,5 г натриевой соли дихлоризоциануровой кислоты или кальция гипохлорита нейтрального, или 2,2 — 2,8 г хлорной извести взвешивают с погрешностью не более 0,0002 г, переносят в фарфоровую ступку, добавляют 30 — 40 см 3 воды и растирают пестиком до образования однородной массы.
После отстаивания водный слой декантируют в мерную колбу вместимостью 500 см 3 . К остатку в ступке добавляют около 20 см 3 воды, тщательно растирают и переносят всю массу количественно в ту же колбу. В случае исследования натриевой соли дихлоризоциануровой кислоты навеску сразу переносят в мерную колбу. Объем жидкости в колбе доводят до метки водой, тщательно перемешивают и, не давая осадку осесть, отбирают пипеткой 50 см 3 раствора в коническую колбу вместимостью 500 см 3 . В эту же колбу вносят затем 10 см 3 раствора йодистого калия, перемешивают, прибавляя 50 см 3 раствора серной кислоты, закрывают колбу пробкой, снова перемешивают и помещают в темное место. Через 5 мин выделившийся йод титруют раствором серноватистокислого натрия до соломенно-желтого цвета, добавляют 1 — 2 см 3 раствора крахмала и продолжают титрование до обесцвечивания раствора.
6.6.3. Определение массовой доли активного хлора в растворах вышеуказанных препаратов (п. 6.6.2.) и гипохлорите натрия.
10 см 3 раствора отбирают пипеткой и переносят в мерную колбу вместимостью 250 см 3 , доводят объем раствора водой до метки и тщательно перемешивают.
10 см 3 приготовленного раствора переносят пипеткой в коническую колбу вместимостью 250 см 3 , прибавляя 10 см 3 йодистого калия и 20 см 3 серной кислоты, перемешивают, закрывают колбу пробкой и ставят в темное место.
Через 5 мин титруют выделившийся йод до обесцвечивания раствора.
6.6.4. Обработка результатов.
Массовую долю активного хлора (X) в процентах вычисляют по формуле:
V — объем точно 0,1 н. раствора серноватистокислого натрия, израсходованный на титрование анализируемой пробы, см 3 ;
0,0035453 — масса активного хлора, соответствующая 1 см 3 точно 0,1 н. раствора серноватистокислого натрия, г;
А — исходный объем приготовленного раствора, см 3 ;
m — масса навески препарата, г;
Б — масса раствора, взятого для титрования, см 3 .
За результат анализа принимают среднее арифметическое двух параллельных определений, допускаемые расхождения между которыми не должны превышать 0,3 %.
С утверждением настоящих «Методических указаний . » отменяется действие Приложения 4 к «Инструкции по проведению ветеринарной дезинфекции, дезинвазии, дезинсекции и дератизации» утвержденной 8.12.1968 г. «Методики бактериологического контроля качества дезинфекции при туберкулезе», утвержденной 20.05.82 г. «Методических указаний по ускоренному выделению санитарно-показательных микроорганизмов с поверхностей животноводческих объектов для контроля качества дезинфекции», утвержденных 2.07.86 г., п. 13 «Инструкции по ветеринарно-санитарной обработке вагонов после перевозки животных, продуктов и сырья животного происхождения», утвержденной 17.12.85 г. (бактериологический контроль качества дезинфекции).
Методические указания по контролю качества дезинфекции разработаны Всесоюзным ордена Дружбы народов научно-исследовательским институтом ветеринарной санитарии, Всесоюзным ордена Ленина научно-исследовательским институтом экспериментальной ветеринарии им. Я.Р. Коваленко, Центральной ветеринарной лабораторией и Омским ветеринарным институтом.
Видео:1 3 Правовые критерии качества и безопасности медицинской деятельности - Юлия Владимировна ПавловаСкачать

Приложение
к Методическим указаниям по
контролю качества дезинфекции
1. Приготовление нейтрализующих растворов.
Нейтрализующие растворы готовят в концентрации в 10 раз меньшей чем концентрация использованного дезинфицирующего средства.
Раствор готовят на стерильной воде в стерильной посуде и разливают в пробирки или флаконы с соблюдением правил стерильности. (Растворы уксусной кислоты и бикарбоната натрия можно стерилизовать автоклавированием). Раствор аммиака стерилизации не подлежит. Готовые пробирки (флаконы) можно хранить в течение 5 дн при комнатной температуре.
2. Приготовление тампонов.
Ватные или марлевые тампоны для взятия смывов монтируют на алюминиевой проволоке, пропущенной через резиновую пробку. В пробирки разливают по 10 мл физиологического раствора, закрывают резиновыми пробками с вмонтированными тампонами и стерилизуют автоклавированием при 1 атм в течение 30 мин.
3. Подготовка материалов для исследования методом отпечатков.
3.1. Подготовка предметных стекол. Для исследования используют предметные стекла (размером 2,5×7,5 см) или стекла, разрезанные вдоль на две половинки (1,2×7,5 см). Стекла предварительно кипятят 10 — 15 мин в 2 — 5 %-ном растворе моющего порошка типа «Лотос» «Новость» и т.п., затем поверхность предметных стекол с двух сторон натирают с помощью зубной щетки или ерша этим же порошком, слегка увлажненным водой после чего тщательно промывают в проточной воде, ополаскивают дистиллированной водой и высушивают на воздухе. Подготовленные стекла хранят в банке с притертой крышкой в сухом виде.
3.2. Обработка ванн и пробирок, предназначенных для транспортировки, хранения и инкубирования проб-отпечатков. При взятии проб на широкие стекла используют пластмассовые ванны для окраски мазков крови на предметном стекле (ТУ-64-1), на узкие — бактериологические пробирки, закрытые резиновыми пробками.
Пластмассовые ванны разбирают и тщательно моют горячим мыльным раствором, после чего ополаскивают вначале водопроводной водой, затем 65 — 70 %-ным этиловым спиртом или кипящей дистиллированной водой и облучают в течение 2 ч ультрафиолетовыми лучами. На дно обработанной указанным способом ванны помещают стерильную фильтровальную бумагу, затем ванны собирают и закрывают крышками.
Бактериологические пробирки и резиновые пробки моют и стерилизуют общепринятым способом. Перед стерилизацией на дно пробирки помещают небольшой ватный тампон.
3.3. Подготовка предметных стекол со средой. В стерильном боксе на предметные стекла наносят тонкий слой расплавленной питательной среды: для выделения группы бактерий кишечной палочки используют агар Эндо, стафилококков — 8,5 %-ный солевой мясо-пептонный агар (рН 7,2 — 7,4). Количество нанесенной среды должно соответствовать 0,15 мл (4 капли) для узкого предметного стекла и 0,33 мл (8 капель) для широкого.
Перед нанесением на стекло среду, находящуюся в пробирках, ставят в водяную баню и расплавляют. В расплавленную среду погружают стерильную пастеровскую пипетку. Температуру воды в бане поддерживают в пределах 80 — 90 °С.
Прогретые над пламенем горелки предметные стекла раскладывают на ровной, строго горизонтальной поверхности стола. Предметные стекла берут корцангом, слегка подогревают и наносят пипеткой указанное количество питательной среды, отступя на 2 — 2,5 см от поперечного края стекла. Затем, расположив горизонтально пастеровскую пипетку, питательную среду быстро распределяют по средней трети поверхности стекла. Распределив среду, стекла раскладывают на строго горизонтальную поверхность стола и подсушивают при комнатной температуре до появления вокруг питательной среды высушенной полосы шириной 0,5 — 1 мм. Широкие стекла со средой помещают в пластмассовые ванны, узкие — в пробирки.
Ванны и пробирки предварительно увлажняют, внеся на дно 1 или 0,1 мл стерильной водопроводной воды соответственно.
Для удобства транспортировки ванны устанавливают в биксы, пробирки — в металлические пеналы или в специально приспособленную сумку.
Подготовленные предметные стекла с солевым агаром хранятся при температуре +4 °С до 10 сут, со средой Эндо — 2 — 3 сут (если нет видимого изменения цвета среды).
4. Подготовка стекол для микрокультивирования микобактерий.
Предметные стекла разрезают вдоль на узкие стекла размером 1,2×7,5 см, моют и помещают на 2 ч в хромпик, который готовят следующим образом: берут двухромовокислый калий (40 г) помещают в фарфоровую кружку или эксикатор и растворяют в небольшом количестве воды, затем добавляют осторожно концентрированную серную кислоту до общего объема 1 л.
После хромпика стекла вновь моют дистиллированной водой, протирают чистой льняной тканью, стерилизуют сухим жаром (160°) в течение 2 ч и хранят в закрытых сосудах (эксикаторах).
5. Приготовление питательных сред.
5.1. Среды для выделения кишечной палочки.
5.1.1. Модифицированная среда Хейфеца.
К 1 л дистиллированной воды добавляют 10 г пептона, 5 г хлорида натрия и 4 г лактозы. Смесь доводят до кипения, затем фильтруют и после остывания определяют рН, который должен быть в пределах 7,4 — 7,8. Затем к среде добавляют в качестве индикатора 1 мл 5 %-ного водного раствора метиленовой сини. Среду разливают в пробирки по 5 мл и стерилизуют в автоклаве при 0,5 атм 15 мин. Исходный цвет среды — красновато-сиреневый.
5.1.2. Питательная среда КОДА сухая. Состав и способ приготовления приведены в этикетке на упаковке среды.
5.2. Среды для выделения стафилококка.
5.2.1. Солевой мясо-пептонный бульон. К обычному МПБ с рН 7,2 — 7,4 добавляют 6,0 % натрия хлорида квалификации «ХЧ» или «ЧДА», перемешивают до полного растворения соли, разливают в пробирки по 5 мл и стерилизуют при 1 атм в течение 20 — 30 мин.
5.2.2. Солевой мясо-пептонный агар. К расплавленному МПА добавляют 8,0 % натрия хлорида квалификации «ХЧ» или «ЧДА», перемешивают до полного растворения соли, разливают в колбы и стерилизуют при 1 атм 20 — 30 мин. Перед использованием солевой агар разливают в стерильные бактериологические чашки по 10 — 15 см. После застывания среды ее подсушивают в термостате в течение 1 ч.
5.3. Дифференциально-диагностическая среда для индикации Вас. anthracis
5.3.1. Приготовление растворов ингредиентов.
Полимиксина М сульфат во флаконе растворяют в стерильной дистиллированной воде, а затем последовательными разведениями стерильным 0,9 %-ным раствором натрия хлорида доводят до концентрации 10000 ЕД/мл.
Невиграмон переносят в стеклянный флакон или пробирку и растворяют в 25 %-ном водном растворе аммиака при тщательном перемешивании стеклянной палочкой. Затем последовательно разводят стерильным 0,9 %-ным раствором натрия хлорида до концентрации 100 мкг/мл.
Моющее средство «Прогресс» разводят стерильной дистиллированной водой до 0,1 %-ной концентрации.
Гризеофульвин в таблетках тщательно растирают в ступке, затем растворяют в стерильной дистиллированной воде до содержания 100 мкг препарата в 1 мл.
Фенолфталеинфосфат натрия (продажный 10 %-ный раствор) для стерилизации прогревают на водяной бане при 56 °С в течение 30 мин.
5.3.2. Приготовление дифференциально-диагностической среды.
Питательный агар в колбах по 100 мл расплавляют в кипящей водяной бане и охлаждают до температуры 45 — 50 °С. Затем в агар добавляют основные растворы:
📹 Видео
Отдел контроля качестваСкачать

Просто о сложном: Внутрилабораторный контроль качестваСкачать

Внутренний контроль качества в лаборатории - Internal Quality ControlСкачать

Управление качеством, продукции процессов и услуг (по отраслям) (27.02.07)Скачать

Как происходит контроль качества?Скачать

Как разработать программу производственного контроля?Скачать

Современные требования контроля качества мед. деятельности и качества оказания услуг во фтизиатрииСкачать

Основы дезинфекции. Профессор Г.Н.ЧистенкоСкачать

Контроль качества и безопасности медицинской деятельностиСкачать