Минздрав СССР: Приказ № 1021 от 25.12.1973
ПРИКАЗ ПО МИНИСТЕРСТВУ ЗДРАВООХРАНЕНИЯ СССР
г. Москва № 1021 25 декабря 1973 г.
- О введении нового перечня токсикологических веществ, подлежащих судебно-химическому исследованию в лабораториях бюро судебно-медицинской экспертизы
- ПЕРЕЧЕНЬ токсикологических веществ, подлежащих судебно-химическому исследованию в лабораториях бюро судебно-медицинской экспертизы
- 1. Группы веществ, на которые должны производиться исследования при общем анализе
- 2. Вещества, на которые расширяют общий анализ в зависимости от клинической и секционной картины, результатов гистологического, гистохимического исследования, особенностей течения химических реакций и т.д.
- Количественное определение.
- 4 Группа веществ, изолируемых минерализацией
- Рекомендуемые файлы
- 🔥 Видео
Видео:Судебно-химические исследования | Введение в специальностьСкачать

О введении нового перечня токсикологических веществ, подлежащих судебно-химическому исследованию в лабораториях бюро судебно-медицинской экспертизы
При судебно-медицинском исследовании трупов нередко возникают вопросы, связанные с установлением отравления. В этих случаях в судебно-медицинские лаборатории направляются различные объекты исследования, преимущественно внутренние органы из трупа и биологические жидкости.
В отдельных случаях лечебные учреждения могут направлять в судебно-медицинские лаборатории рвотные массы, промывные воды, мочу, кровь и остатки лекарственных веществ.
Судебно-химический анализ объектов исследования производится на основании: постановления органов дознания, следствия, прокуратуры; определения суда, письменного направления судебно-медицинского эксперта; письменного направления руководителя лечебного учреждения с визой начальника бюро судебно-медицинской экспертизы.
В постановлении (определении) или направлении должна быть точно сформулирована цель исследования, в соответствии с которой выполняется судебно-химический анализ на указанное конкретное вещество или группу веществ.
При отсутствии достаточных данных (определенной клинической и секционной картины, обстоятельств дела и т.д.) перед экспертом-химиком может быть, в порядке исключения, поставлен вопрос о проведении общего анализа.
Номенклатура веществ, на которые производятся судебно-химические исследования, в последние годы значительно расширилась.
Перечень исследуемых веществ, приведенный в «Правилах судебно-химической экспертизы вещественных доказательств в судебно-химических отделениях судебно-медицинских лабораторий органов здравоохранения», утвержденных в 1956 г., не отражает настоящего положения и не способствует составлению экспертом-химиком объективно обоснованного плана анализа направленных ему биологических объектов.
В, связи с изложенным, ПРИКАЗЫВАЮ:
1. Утвердить и ввести в действие новый «Перечень токсикологических веществ, подлежащих судебно-химическому исследованию в лабораториях бюро судебно-медицинской экспертизы органов здравоохранения» (см. приложение).
2. Считать утратившими силу §§ 54 и 55 «Правил судебно-химической экспертизы вещественных доказательств в судебно-химических отделениях судебно-медицинских лабораторий органов здравоохранения», утвержденных 1 декабря 1956 г. Министерством здравоохранения СССР.
Приложение
к Приказу по Министерству
здравоохранения СССР
№ 1021
от 25 декабря 1973 г.
Видео:«Производство судебно-медицинской экспертизы (исследования) трупа»Скачать

ПЕРЕЧЕНЬ
токсикологических веществ, подлежащих судебно-химическому исследованию в лабораториях бюро судебно-медицинской экспертизы
1. Группы веществ, на которые должны производиться исследования при общем анализе
1.1. Вещества, изолируемые с водяным паром:
Синильная кислота и ее соединения, метиловый, этиловый, пропиловый, бутиловый, амило-вый спирты, формальдегид, хлороформ, хлоралгидрат, четыреххлористый углерод, дихлорэтан, фенол, крезолы.
1.2. Вещества, изолируемые минерализацией:
Ртуть, мышьяк, таллий, кадмий, свинец, барий, медь, марганец, хром, цинк, сурьма, серебро, висмут.
1.3. Органические вещества, изолируемые подкисленной водой или подкисленным спиртом, другими органическими растворителями:
Барбитал, фенобарбитал, барбамил, этаминал, циклобарбитал, гексобарбитал, бензонал, морфин, кодеин, дионин, героин, гидрокодон, папаверин, промедол, стрихнин, атропин, гиосциамин, скополамин, кокаин, пахикарпин, анабазин, никотин, аминазин, дипразин, тизерцин, мажептил, трифтазин, имизин и его аналоги, карбофос, метафос, метилэтилтиофос, метил-нитрофос, три-хлорметафос-3, металмеркаптофос, фосфамид, фталофос, фозалон, бутифос, хлорофос, октаметил, севин.
2. Вещества, на которые расширяют общий анализ в зависимости от клинической и секционной картины, результатов гистологического, гистохимического исследования, особенностей течения химических реакций и т.д.
2.1. Вещества, изолируемые с водяным паром:
Тетраэтилсвинец, этиленгликоль, ацетон, нитро- и динитробензолы, анилин, бензол, ксилол, толуол, бензин, керосин.
2.2. Вещества, изолируемые минерализацией:
Селен, теллур, олово, железо, молибден, бериллий, никель, кобальт, литий, ванадий.
2.3. Вещества, изолируемые подкисленной водой и подкисленным спиртом, другими органическими растворителями:
Салициловая, ацетилсалициловая, бензойная кислоты, производные барбитуровой и тиобарбитуровой кислот, не указанные в п. 1.3; сантонин; феликс-флороглюциды; мепробамат; триоксазин; мидокалм; ноксирон; новокаин, дикаин, лидокаин; амидопирин, анальгин, антипирин, бутадион, ареколин, бруцин, кониин; кофеин; хинин, хинидин; резерпин; галантамин, секуринин; эфедрин; пилокарпин; платифиллин, саррацин;. аконитин, вератрин; прозерин, хингамин; ипразид, тубазид, фтивазид, ИНГА-17; производные фенотиазинового ряда, не отмеченные в п. 1.3; элениум, нитразепам, седуксен; карбахолин, декаметоний, димедрол, гексамидин; строфантины К и Г, лантозиды, олеандрин, дигитоксин, дигоксин; фосфорорганические соединения, не отмеченные в п. 1.3; ДДТ, гексахлоран, 2,4-Д, полихлорпинен, гептахлор; зоокумарин; альфанафтилтиомочевина, антабус, тиурам; ДНОК, ртутьорганические соединения.
2.4. Вещества, изолируемые диализом:
Азотная кислота, нитраты, нитриты, серная, соляная, уксусная, муравьиная, щавелевая и дру-гие кислоты, едкие кали и натр, гидроокись аммония.
2.5. Вещества, изолируемые специальными методами:
Фосфид цинка; соли фтористоводородной, кремнефтористой, хлорной кислот; йод, бром; окись углерода.
Главный судебно-медицинский эксперт
Министерства здравоохранения СССР
Заслуженный деятель науки РСФСР
профессор
Видео:5 самых опасных ядовСкачать

Количественное определение.
Фотоколориметрический метод. Он основан на р-ции образования полиметинового красителя с помощью пиридин-бензидинового реактива. Ч/з 15 мин измеряют оптическую плотность полученного раствора с помощью ФЭК-М в кювете 5 мм при длине волны 530 нм. В качестве раствора сравнения используют смесь реактивов. Ошибка методики находится в пределах ±5-6%.
Несмотря на широкое внедрение инструментальных методов, титриметрические методы не теряют своего значения при некоторых химико-токсикологических исследованиях.
Аргентометрический метод (метод Фолъгарда).Используется при содержании синильной кислоты >1 мг в 100 г исследуемого объекта. Из навески объекта синильную кислоту изолируют с помощью перегонки с водяным паром. Дистиллят собирают в при- емник, в котором находится раствор нитрата серебра (концентрация раствора нитрата серебра подбирается в зависимости от количества синильной кислоты). Непрореагировавший нитрат серебра оттитровывают раствором тиоцианата аммония, используя железоаммониевые квасцы в качестве индикатора. Этот метод нельзя использовать при анализе гнилостно-разложившегося объекта, так как при гниении биологического материала образуется сероводород, который также перегоняется с водяным паром и реагирует с нитратом серебра.
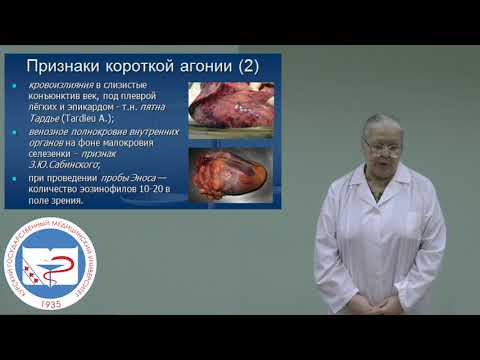
44. Перечень металлических ядов, подлежащих судебно-химическому исследованию. Токсичность и физико-химические свойства. Подготовка биологических образцов к анализу. Способы минерализации.
Важнейшими «металл. ядами» явл-ся соед-я бария, висмута, кадмия, марганца, меди, ртути, свинца, серебра, таллия, хрома, цинка и некоторых других металлов. В токсикологии к группе «металл. ядов» относятся и соединения некот. неметаллов (мышьяка, сурьмы и др.). Ряд перечисленных выше хим. эл-тов, соед-я к-х явл-ся токсичными, в небольших кол-вах сод-ся в тканях орг-зма как нормальная их составная часть. Ввиду незначительных кол-тв этих хим. эл-тов, соде-щихся в организме, их называют микроэлементами. Несмотря на то что отдельные Ме в малых кол-вах сод-ся в организме как нормальная его составная часть, при повышении содержания их в крови и тканях они вызывают отравления. Токсичность «металлических ядов» объясняется связыванием их с соответствующими функц. группами белковых и других жизненно важных соед-й в организме. В рез-те связывания катионов металлов белками и другими в-вами нарушаются нормальные функции соответствующих клеток и тканей в организме и наступает отравление, к-е в ряде случаев заканчивается смертью. Накопление металлов в орг-зме м.б. вызвано природными факторами или техногенными загрязнениями. При этом возникают заболевания, называемые гипермикроэлементозами, обусловленные избыточным сод-нием в орг-зме того или иного эл-та.
Отбор и подготовка проб для минерализации.
Анализу подвергают органы трупов (печень, почки, желудок с содержимым и др.), био. жидкости (кровь, моча), пищевые продукты и другие объекты. Кол-во исследуемого мат-ла, необходимое для каждого анализа, зависит от общей массы объекта, поступившего на исследование, и от обстоятельств дела. Если из материалов дела известно, что умерший после отравления «металл. ядами» еще жил долгое время, в теч. к-го в-во, вызвавшее отравление, хотя бы частично могло выделиться из орг-зма, а также при наличии данных о том, что умершим была принята небольш. доза яда, то на иссл-ние по возможности берут большее кол-во био. мат-ла. При отсутствии таких данных на иссл-ние берут пробы по 100 г био.материала. Каждую пробу био. материала минерализуют раздельно, не допуская смешивания этих проб. Если на химико-токсиколог. анализ поступили относительно большие навески органов трупов или пищевых продуктов, то на исслед-ние можно брать несколько порций каждого объекта (массой по 100 г) и каждую порцию разрушать отдельно. Затем соединять минерализаты, полученные из одного и того же объекта. Если же на анализ поступают малые количества объектов, то для исслед-ния м. б. исп-ван био. материал, из к-го ранее были отогнаны летучие яды с водяным паром. Такой био. материал сод-жит больш. кол-во воды, мешающей минер-ции. При наличии больш. кол-ва воды в объекте трудно создать соответствующую конц-цию кислот-окислителей, необходимых для мин-ции. Поэтому перед мин-цией из объектов удаляют основную массу воды упариванием на вод. бане. Так же поступают и с др. объектами (моча), богатыми водой. Их упаривают до небольш. объема, а затем проводят мин-цию находящихся в них орг. в-в. На исслед-ние могут поступать органы трупов, консервированные этил. спиртом. При мин-ции био. материала, сод-щего этил. спирт, может произойти загорание спирта. Это обстоятельство особенно нужно учитывать при мин-ции био. материала хлорной к-той и ее смесями с др. к-тами, а также при мин-ции био. мат-ла хлоратом калия КClО3 и соляной к-той или пергидролем и серной к-той. К био. материалу, консервированному этил. спиртом, прибавляют р-р карбоната натрия, хорошо перемешивают и на вод. бане, нагретой не выше 50 °С, отгоняют этил. спирт. После отгонки спирта приступают к мин-ции био. материала.
Способы минерализации.
Мметалл. яды, вызвавшие отравление, могут находиться в орг-зме в виде соед-ний с белками, пептидами, аминок-тами и некот. др. в-вами, выполняющими важную роль в жизненных процессах. Связи металлов с большинством указанных в-в явл-ся прочными (ковалентными). Поэт. изолировать «металл. яды» из био. материала путем настаивания его с орг. раств-лями или с др. извлекающими ж-стями (подкисленный этил. спирт, подкисленная вода) не представляется возможным. Для исследования био.материала на наличие «металл. ядов» необходимо разрушить орг. в-ва, с к-ми связаны металлы, и перевести их в ионное состояние. Методы, применяемые для этой цели, можно подразделить на две группы: методы сухого озоления и методы мокрого озоления, или мокрой мин-ции. Выбор метода мин-ции зависит от св-тв исследуемых элементов, кол-ва пробы био. материала, поступившего на анализ, и т. д.
Метод сухого озоления основан на нагревании орг. в-в до высокой т-ры при доступе воздуха. Сухое озоление производят в фарфоровых, кварцевых или платиновых тиглях. При разрушении орг. в-в с пом. этого метода на исслед-ние берут относительно небольш. навески (1-10 г) исследуемых объектов (пищ. продукты, био. материал и др.) и нагревают их в тигле до 300-400 °С. Увеличение навесок исследуемых объектов явл-ся нежелательным, т. к. это значительно увеличивает время озоления. Недостатки: улетучивание некот. металлов или их соединений в процессе нагревания, а также взаим-вие отдельных металлов с материалом тиглей. При сухом озолении трудно контролировать т-ру исследуемого материала непосредственно в тигле.
Выполнение сухого озоления. Метод применяется тогда, когда имеется специальное задание исследовать объекты био. происхождения на наличие марганца, меди и неко. других металлов. Исследуемые объекты (растительные консервы или части органов) измельчают, вносят в фарфоровые чашки, к-е помещают на нагретую песочную баню, и высушивают исследуемую пробу. Затем при дальнейшем осторожном нагревании песочной бани обугливают эту пробу. Обуглившийся или превращенный в пепел био. материал охлаждают, смачивают конц. р-ром нитрата аммония или конц. азотной к-той. Фарфоровую чашку помещают на кипящую вод. баню и высушивают ее содержимое, к-е переносят в фарфоровый тигель вместимостью 30-50 мл, и осторожно нагревают на слабом пламени. При этом пламя не должно соприкасаться с дном тигля. Нагревание тигля производят таким образом, чтобы его содержимое постепенно превращалось в золу и не было вспышки. При неполном сгорании орг. в-в зола в тигле имеет черный или серый цвет. Для полноты сгорания содержимого тигля его смачивают конц. р-ром нитрата аммония, высушивают на вод. бане и прокаливают. После этого тигель охлаждают, а к его содержимому прибавляют р-р соответствующей к-ты (соляной или азотной) для переведения оксидов металлов в их соли. При исследовании полученного минерализата на наличие марганца золу обрабатывают соляной к-той, а при исслед-нии на наличие меди — азотной к-той. После обработки золы соответствующей к-той содержимое тигля фильтруют. Фильтрат выпаривают на кипящей водяной бане досуха. Сухие остатки растворяют в 3-5 мл воды и полученные р-ры исследуют на наличие катионов соотв-щих металлов (марганца или меди). Сухое озоление орг. веществ должно производиться в вытяжном шкафу с хорошей тягой.
Метод сплавления орг. в-в с нитратами в химико-токсиколог. анализе применяется чаще, чем метод сухого озоления. Пользуясь методом сплавления, био. материал или другие орг. в-ва нагревают с расплавленными нитратами щелочных металлов. С повышением т-ры окислительные св-ва нитратов усиливаются. При этом может происх. быстрое окисление орг. в-в, сопровождающееся выбрасыванием из тигля мелких частиц сожженной пробы. Отмечены случаи взрыва при нагревании некот. орг. в-в с нитратами. Для предотвращения протекания слишком бурной р-ции, к-я может сопровождаться взрывом, при сплавлении применяют не нитраты, а их смеси с карбонатами щелочных металлов.
Выполнение сплавления. Метод применяется при специальных заданиях исследовать соответствующие объекты (пилюли, органические соединения, содержащие металлы, остатки после выпаривания мочи, волосы, ногти и др.) на наличие мышьяка, серебра и некоторых других металлов.
1—2 г исследуемого объекта вносят в фарфоровую чашку, прибавляют 4—6 г смеси, состоящей из двух частей карбоната натрия и одной части нитрата натрия, перемешивают, смачивают водой и при нагревании на водяной бане высушивают доеуха. В фарфоровый тигель вместимостью 30—50 мл вносят 5—6 г нитрата натрия. Тигель осторожно нагревают до полного расплавления нитрата натрия. Затем уменьшают пламя и в тигель небольшими порциями вносят указанную выше высушенную в фарфоровой чашке смесь исследуемого объекта, нитрата и карбоната натрия. Каждую новую порцию этой смеси вносят в тигзль после сгорания предыдущей и перехода ее в расплавленное состояние.
После сжигания последней порции смеси в фарфоровую чашку, в которой находилась эта смесь, вносят 2—3 г карбоната натрия, хорошо перемешивают, чтобы остатки исследуемого объекта, оставшиеся на стенках фарфоровой чашки, хорошо смешались с карбонатом натрия. Карбонат натрия вносят в тигель для сжигания исследуемой смеси. При сплавлении смеси пламя горелки регулируют так, чтобы в тигле не вспыхивало пламя и с выделяющимися газами не удалялось исследуемое вещество.
После сжигания всей смеси тигель охлаждают, а его содержимое обрабатывают кипящей водой. Полученный раствор применяют для обнаружения и количественного определения «металлических ядов».
Описанный выше метод минерализации непригоден для исследования объектов биологического происхождения на наличие соединений ртути, так как они улетучиваются при нагревании с нитратом и карбонатом натрия.
Качественный анализ «металлических ядов». Дробный метод анализа. Сущность метода. Особенности. Принципы и способы разделения ионов металлов (жидкость-жидкостная экстракция хелатов металлов, ионных ассоциатов, реакции осаждения, комплексообразования и пр.). Органические реагенты в дробном методе анализа.
Дробный метод анализа «металлических ядов». Для обнаружения и колич. определения «металл. ядов» испо-ся минерализаты, полученные после разрушения био. материала, сод-щего эти яды. Обнаружению ионов исследуемых металлов могут мешать ионы других эл-тов. В химико-токсиколог. ан-зе для обнаружения ионов металлов в минерализатах применяется дробный метод. Он основан на применении р-ций, с пом. к-х в любой послед-сти можно обнаружить искомые ионы в отдельных небольших порциях исследуемого р-ра. Пользуясь дробным методом, отпадает необходимость выделения исследуемых ионов из р-ров. Для обнаружения соотв-щих ионов дроб. методом необходимо применять специфическ. реактивы, позволяющие обнаружить искомый ион в присутствии посторонних ионов. Однако не всегда можно подобрать специфические реакции для обнаружения искомых ионов. В этих случаях в дробном анализе пользуются специальным приемом (маскировкой), с пом. к-го устраняется влияние мешающих ионов. Обнаружение искомых ионов дробным методом производится в два этапа. Вначале устраняют влияние мешающих ионов с пом. соотв-щих реактивов или их смесей, а затем прибавляют реактив, дающий окраску или осадок с искомым ионом.
Маскировка ионов. Маскировкой наз-ся процесс устранения влияния мешающих ионов, находящихся в сложной смеси, на обнаружение искомых ионов. При маскировке мешающие ионы переводят в соед-я или в др. ионы, к-е теряют спос-сть реагировать с реактивами на искомые ионы. Сущ-ет неск-ко способов маскировки ионов. С целью маскировки мешающие ионы переводят в устойчивые комплексы, изменяют валентность
этих ионов при помощи окислителей или восст-лей, изменяют рН среды и т. д.Основным способом маскировки мешающих ионов, к-й применяется в аналит. химии и в химико-токс. анализе, явл-ся комплексообразование. Пользуясь этим способом, для маскировки подбирают такой реактив, к-й с мешающими ионами образует бесцвет. прочные комплексные ионы, не способные реагировать с реактивами на искомые ионы. Демаскировка ионов. Демаскировкой называют процесс освобождения ранее замаскированных ионов от маскирующих реактивов. В рез-те демаскировки ранее замаскированные ионы восстанавливают спос-сть вступать в р-ции с соотв-щими реактивами. Демаскировка в основном осущ-ся разложением комплексных ионов, к-е ранее образовались в процессе маскировки.
Реактивы, применяемые в дробном анализе для маскировки.
1. Цианиды. Применение цианидов для маскировки ионов основано на том, что с их помощью мешающие ионыможно перевести в комплексы: [Co(CN)6] 4- , [Fe(CN)6 ] 4- , [Fe(CN)6 ] 3- и др. Широкое применение цианидов объясняется тем, что при необх-сти из комплексныхцианидов можно легко демаскировать катионы соотв-щих металлов. Цианиды довольно токсичны. Их нельзя прибавлять к кислым р-рам, т. к. в присутствии
к-т происх. разложение цианидов и выделяется летучая очень ядовитая синильная к-та. Поэт. работа с цианидами должна производиться под вытяжным шкафом. 2. Фториды часто исп-ся для маскировки ионов железа (III), с к-ми они образуют бесцвет. устойчивые комплексные ионы [FeF6] 3- . 3. Фосфатытакже применяются для
ионов железа (III). В кислой средефосфаты и фосфорная к-та с ионами железа образуют бесцвет. комплексы [Fe(PO4)2] 3- . 4. Тиосульфаты применяются для маскировки ионов серебра, свинца, железа (III), меди и других катионов. Образуются комплексы:
[Ag2(S2O3)3] 4- , [Pb(S2O3)3] 4- , [Fe(S2O3)2]-. 5. Гидроксиламин.Маскирующее действие гидроксиламина основано на том, что с одними ионами он образует комплексы, а с другими — вступает в реакции окисления-восстановления. В зависимости от природы ионов, с к-ми реагирует гидроксиламин, он может быть окислителем или восст-лем. 6. Тиомочевинатиомочевина исп-ся для маскировки ионов висмута, железа (III), сурьмы
(III), кадмия, ртути, серебра и др. С указанными ионами тиомочевина образует прочные внутрикомплексные соед-я. 7. Глицерин.С катионами висмута, свинца, кадмия и другими глицерин образует глицераты: С некот. ионами глицерин дает окрашенные соед-я. Образование этих соединений исп-ся в анализе для идентификации ионов. 8. Комплексен III(трилон Б) довольно часто исп-ся для маскировки ионов кадмия, кобальта, меди, железа, марганца, свинца, цинка, магния и др. При взаим-вии комплексона III с указанными ионами образуются прочные внутрикомплекс. соед-я. 9. Лимонная кислота и ее соли (цитраты) с катионами ряда металлов дают прочные соединения. Исп-ся для маскировки ионов висмута, меди, железа (III), сурьмы (III), кадмия, ртути, серебра и некот. др. 10. Винная кислота и ее соли (тартраты) с многими металлами образуют прочные растворимые в воде комплексы. Исп-ся для маскировки ионов меди, железа (III), алюминия, висмута, кадмия, ртути, свинца, цинка и др. 11. Аскорбиновая к-та. Применение аскорбиновой кислоты как маскирующего средства в основном базируется на восстановительных св-вах этой к-ты. При взаим-вии аскорбиновой к-ты с сильными окис-лями она переходит в щавелевую или треоновую к-ту, а при взаим-вии с окислителями средней силы аскорбиновая к-та превращается в дегидроаскорбиновую к-ту.
Реакции, применяемые для обнаружения ионов металлов. Для обнаружения ионов металлов, сод-щихся в минерализатах, применяют р-ции образования осадков, микрокристаллоскопические и цветные р-ции. В ряде случаев для этой цели применяются физико-хим. методы. Поскольку некот. токсикологически важные металлы явл-ся норм. сост. частью тканей организма, р-ции, применяемые для обнаружения этих металлов в минерализатах, по чувств-сти д. б. такими, к-е не дают положительного рез-та с микрокол-вами ионов металлов, входящих в состав тканей орг-зма. Желательно, чтобы эти реакции были положительными т-ко с относительно большими кол-вами ионов металлов, соед-я к-х вызвали отравление. Большинство окрашенных соед-й, образующихся при взаим-вии ионов металлов с соотв-щими реактивами, явл-ся комплексами или ионными ассоциатами.
Ионные ассоциаты. В аналит. химии и химико-токс. ан-зе для идентиф-ции и фотометрическ. определения ряда в-в прим-ся р-ции образования ионных ассоциатов. Ионные ассоциаты (ионные пары) предст. соб. не полностью диссоциированные солеобразные соед-я. Они образ-ся в рез-те ассоциации противоположно заряженных ионов. Спос-стью образовывать ионные ассоциаты в основном обладают крупные ионы.
В анализе исп-ся р-ции образования ионных ассоциатов при взаим-вии хлорантимонатов с метиловым фиолетовым, бриллиантовым зеленым и др. Описаны ионные ассоциаты цезия с тетрародановисмутатом. Ионные ассоциаты образуются катионами основных красителей с анионами, предст-щие собой ацидокомплексы металлов ([HgCl4] 2- , [HgI4] 2- , [BiI4] и др.). Для обнаружения мышьяка исп-ся ионные ассоциаты, к-е образ-ся при взаим-вии мышьяковистого водорода с диэтилдитиокарбаминатом серебра в пиридине, и т. д.
Р-ции образования внутрикомплексных соед-й. Для идентификации и колич. определения катионов металлов в химико-токс. анализе широко исп-ся р-ции образования внутрикомплекс. соед-й. В кач-ве реактивов для указанной цели часто применяются дитизон, диэтилдитиокарбаминат аммония и др.
Дитизон (дифенилтиокарбазон) — тонкие сине-черные иглы с фиолет. оттенком. Дитизон практически не раств. в воде, но хор. раств. во многих орг. раств-лях. Для растворения дитизона применяют четыреххлористый углерод или хлороформ. Р-ры дитизона в хлороформе и в некот. др. орг. раств-лях обладают дихроматизмом (темно-красная окраска р-ров дитизона в толстых слоях при разбавлении переходит в ярко-зеленую). Дитизонаты железа и марганца явл-ся нестойкими и быстро разлагаются. Дитизон при хранении подвергается окислению. Поэт. перед употреблением дитизона для аналит. целей он д. б. очищен от примесей.
Диэтилдитиокарбаматы. В химико-токс. ан-зе для разделения и фотометрического определения ионов некот. металлов широко используются соли диэтилдитиокарбаминовой к-ты. Диэтилдитиокарбаминовая к-та (ДДТК) нестойкая. Для аналит. целей в кач-ве реактивов прим-ся натриевая и аммониевая соли диэтилдитиокарбаминовой к-ты. Эти соли хор. раств. в воде, их р-ры бесцветны. Натриевая и аммониевая соли диэтилдитиокарбаминовой к-ты с катионами тяж. металлов образуют внутрикомплексные соединения (диэтилдитиокарбаматы). Для выделения диэтилдитиокарбаматов металлов из р-ров и для разделения их смесей применяют метод экстракции. При этом в ряде случаев пользуются маскирующими ср-вами (цитратами, цианидами, комплексоном III и др.). Из аммиачной среды, сод-щей цитраты и комплексон III, орг. раств-лями экстрагируются диэтилдитиокарбаматы меди, ртути (II), серебра и висмута. При наличии цианидов экстрагируются диэтилдитиокарбаматы висмута, кадмия, свинца и галлия (III). От прибавления минер. к-т к диэтилдитиокарбаматам натрия и аммония они разлагаются и выделяется диэтилдитиокарбаминовая к-та, к-я явл-ся нестойкой. Для экстракции катионов тяж. металлов из р-ров в виде диэтилдитиокарбаматов поступают так: исследуемый р-р доводят до рН = 5 и приб.т р-р диэтилдитиокарбамата аммония или натрия. При этом образуются диэтилдитиокарбаматы соотв-щих катионов. Затем приб. р-р минер. к-ты, в к-й диэтилдитиокарбаматы тяже. металлов не разлагаются, а в теч. 2-3 мин разлагается избыток диэтилдитиокарбамата аммония, являющегося реактивом, с образованием диэтиламина и сероуглерода. После разложения избытка реактива минеральными к-тами экстрагируют диэтилдитиокарбаматы тяжелых металлов орг. раств-лями.
Современные методы разделения и определения ионов металлов (хроматография в тонком слое сорбента, ионообменная хроматография, газовая хроматография, электрофорез). Использование атомно-абсорбционной спектроскопии и других спектральных методов при определении «металлических» ядов.
Атомно-абсорбционная спектрометрия (ААС) предназначена для определения содержания хим. эл-тов путем измерения абсорбции излучения атомными парами определяемого эл-та. Физическую основу метода составляют следующие явления. При поглощении кванта света свободный атом переходит в возбужденное состояние. Наиболее вероятным изменением энергетического состояния атома при возбуждении явл-ся его переход на уровень, ближайший к основному энергетическому состоянию, т.е. резонансный переход. Если на невозбужденный атом направить излучение оптического диапазона с частотой, равной частоте резонансного перехода, кванты света будут поглощаться атомами. При этом наблюдается уменьшение интенсивности излучения, что фиксируется при определенной длине волны. В основе метода — регистрация спектров поглощения атомов, находящихся в газообразном состоянии в пламени при д-вии источника излучения. Способ введения образца зависит от типа используемого генератора. Если генератором атомных паров является пламя, то в кач-ве раст-ля для приготовления р-ров образца и стандарта исп-ют воду. Могут применяться орг. раств-ли, если они не влияют на стабильность пламени. Источник излучения — мощная лампа с полым катодом, к-я испускает излучение с частотой, необходимой для регистрации определяемых эл-тов. Монохроматор — призма, к-я служит для выделения участка спектра с определенной длиной волны. Наиболее часто исп-ся пламя смеси ацетилена с воздухом (макс. т-ра 2000°С), ацетилена с N20, т-ра — 2700°С, ацетилен с кислородом, водо род с воздухом.
Колич. определение методом атомно-абсорбционной спектрометрии проводят по следующей методике. Атомно-абсорбционный спектрометр выводят на режим согласно инструкции завода-изготовителя и устанавливают нужную длину волны. В генератор атомных паров вводят холостой р-р и настраивают детектор на максимальное свето-пропускание. Затем в пламя вводят р-р сравнения определяемого эл-та с наибольшей конц-цией и настраивают детектор так, чтобы получить аналитический сигнал в оптим. диапазоне измерений, после чего проводят анализ исследуемой пробы. Расчет конц-ции проводят по градуировочному графику или по методу добавок.
В химико-токс. анализе метод атомно-абсорбционной спектроскопии предложен и исп-ся для обнаружения и количеств. определения «металл.» ядов. Метод атомно-абсорбционной спектроскопии отличается простотой в выполнении, высокой селективностью, малым влиянием состава пробы на рез-ты анализа. Недостаток метода — невозможность одновременного определения нескольких эл-тов при исп-нии линейных источников излучения. Многоэлементный анализ можно провести, если исп-вать атомно-флуоресцентный, атомно-эмиссионный с индуктивно связанной плазмой или рентгено-флуоресцент-ный анализ. Среди всех методов атомно-абсорбционный анализ нашел более широкое применение в практике химико-токс. анализа. Атомно-абсорбционный метод исп-ся при обнаружении и колич. определении «металл.» ядов в био. материале, крови, моче, пищевых продуктах и других объектах, особенно при проведении сложных, спорных и комиссионных экспертиз.
47. Группа токсикологически важных веществ, изолируемых водой. Общая характеристика. Предварительные пробы. Подготовка биологических образцов к исследованию. Особенности химико-токсикологического анализа кислот (серной, азотной, соляной), щелочей (гидроксиды натрия, калия и аммония), нитратов и нитритов.
К группе в-в, к-е изолируются из различ. объектов настаиванием их с водой, относятся минер. к-ты, щелочи и соли некот. минер. к-т.
Токсиколог. значение. Мин. к-ты широко прим-ся в различ. отраслях промыш-сти и в быту, поэт. часто доступны для населения. Это явл-я одной из причин как случайных, так и умышленных отравлений. Известны криминальные случаи исп-ния серной к-ты для нанесения физич. увечий. С такой же целью могут исп-ваться и остальные к-ты.
При отравлении кислотами чаще всего наблюдаются острые отравления.
Серная к-тавыпускается промыш-стью в виде моногидрата — 98% р-ра серной к-ты, олеума — 20% р-р серного ангидрида в серной к-те, неочищенной серной к-ты или купоросного масла — 93-97% р-р серной к-ты. Серная кислота смешивается с водой в любых отношениях, при этом выделяется большое кол-во тепла. Применяется серная кислота почти во всех областях хим. промыш-сти. Смертельные случаи встречаются при поражении больших участков повер-сти тела или при приеме внутрь 5-10 мл серной к-ты. Азотная к-тапредст. соб. бесцвет. прозрач. ж-сть. Она смешивается с водой во всех отношениях. Открытая емкость с азотной к-той выделяет тяжелые пары, образующие белый дым. Азотная кислота выпускается промыш-стью в виде 50-60% и 96-98% р-в. Азотная к-та прим-ся в хим. промыш-сти при пр-ве удобрений, взрывчатых в-в, ЛП и т.д. По сравнению с серной к-той она менее доступна для населения. При действии азотной к-ты на ткани они приобретают желт. цвет. Отравления азотной кислотой м. б. ингаляционными и пероральными. При приеме внутрь смерт. доза составляет 8-10 мл.
Хлороводородная к-та– р-р хлористого водорода в воде. Промыш-стью выпускается несколько видов хлороводородной к-ты. Наиболее известны: «аккумуляторная», сод-щая примерно 37% хлористого водорода, и концентрированная, сод-щая примерно 25% хлористого водорода. Первая из них имеет довольно много примесей и прим-ся т-ко для технических целей. Вторая является более очищенной, один из ее сортов исп-ся в фармацевт. практике. Разведенная хлороводородная к-та (1:2) готовится из 25% р-ра и явл-ся доступной для населения. При вдыхании хлористого водорода наблюдают раздражение верхних дых. путей и легких. Смерть может наступить от асфиксии в рез-те отека гортани или спазма голосовой щели. При приеме внутрь концентрированной хлороводородной кислоты смерть может наступить от 15-20 мл такого р-ра. Гидроксид натрия— это твердое крист. в-во, раств. в воде, спирте, глицерине. При попадании на кожу или слизистые об-чки образует мягкие струпья. Опасно попадание гидроксида натрия в глаза, т. к. при этом развивается вторичная глаукома, сморщивание глазного яблока. При попадании внутрь симптомы отравления подобны симптомам отравлений к-тами. Смертельная доза гидроксида натрия и других едких щелочей составляет 10-20 г. Гидроксид калия— это белое крист. в-во, оч. легко раств. в воде. При отравлении гидроксидом калия картина сходна с отравлением гидроксидом натрия, но многие р-ции действия на организм выражены сильнее. Аммиак.Насыщенный р-р аммиака содержит до 33% аммиака, 10% его р-р известен как нашатырный спирт. Аммиак имеет широкое применение в хим. синтезах, в холодильной промыш-сти. В мед. практике прим-ся при обморочных состояниях. Р-р аммиака — это слабая щелочь. Он вызывает болезненные воспалительные р-ции с образ-ем сильного отека. При длительном воздействии на организм наблюдается отслоение слизистых оболочек, образование пузырей и некроза. При большой конц-ции аммиака в воздухе наступает паралич ЦНС и быстрая смерть при явлениях асфиксии (цианоз, судороги, остановка дыхания). Нитрат и нитрит натрия— это бесцв. или слегка желтоватые кристаллы, имеют соленый вкус, похожий на вкус хлорида натрия, хор. раств. в воде. Нитрит натрия исп-ся в хим. промыш-сти при пр-ве красителей, фотоэмульсий, иногда в строительстве как антифриз для бетона в зимнее время, в резинотехнической, текстильной и металлообрабатывающей промыш-сти. Нитраты (аммония, щелочных металлов и кальция) явл-ся основными азотными удобрениями. Нитраты — компоненты ракетного топлива, пиротехнических составов, травильных р-ров при крашении тканей, их исп-ют для закалки металлов, как ЛС и в других областях. Нитриты и нитраты относятся к токсичным соединениям. Нитраты вызывают отек легких, кашель, рвоту, острую сердечно-сосуд. недост-сть. Смерт. доза нитратов находится в пределах 8-15 г. Нитриты вызывают голов. боль, рвоту, угнетают дыхание, действуют на сосудистые стенки и угнетают сосудодвигат. центр. При отравлении характерна сине-черная окраска губ, носа, ушных раковин, ногтей, кровь приобретает шоколад. цвет.
Для очистки водных вытяжек из исследуемых объектов применяют фильтрование или центрифугование, а затем метод диализа. Для исслед-ния на наличие минер. к-т и едких щелочей берут желудок с содержимым, остатки пищи, рвотные массы и другие объекты. При исследовании био. материала на наличие солей берут те же объекты и печень. Если в трупном материале минер. к-ты или едкие щелочи после отравления превратились в соотв-щие соли, то обнаружение этих солей в био. материале не проводится, т. к. некот. соли в определенных кол-вах всегда сод-ся в органах и тканях людей и животных.
Изолирование минер. кислот, щелочей и солей из био. материала. Подлежащие исследованию объекты измельчают и приб. к ним дистиллированную воду до получения кашицеобразной массы, к-ю оставляют на 1-2 ч, а затем фильтруют. Для ускорения фильтрования применяют воронки или стаканчики с пористым дном, к-е ч/з соотв-щие приспособления присоединяют к водоструйному насосу. Вместо фильтрования можно применять центрифугирование. Для более полного освобождения вытяжек из био. материала от белковых в-в и некот. др. примесей применяют метод диализа. С этой целью полученные водные вытяжки 2-3 раза подвергают диализу (по 4-6 ч). Диализаты соединяют и упаривают на водяной бане до небольшого объема (5-10 мл). Упаренные диализаты исследуют на наличие к-т, щелочей и солей. При исследовании одежды и некот. др. объектов на наличие к-т, щелочей и солей м. б. исп-ваны водные вытяжки, к-е не подвергались диализу.
Исследование диализата на минер. к-ты. При анализе диализата на минер. к-ты положит. р-цию будут давать как естественно сод-щиеся, так и экзогенные анионы. Поэт. при положит. р-циях предвар. испытаний диализата проводят перегонку кислот в виде их оксидов. Предварительное исследование диализата Вначале проводят испытание диализата на отдельные ионы кислот: 1) Испытание на сульфаты.К 1 мл диализата доб. 0,1 мл 10% р-ра HCl и 1 мл 5% р-ра хлорида бария. При наличии сульфат-ионов образ-ся белый осадок. 2) Испытание на хлориды.К 1 мл диализата доб. 0,1 мл 10% р-ра азотной к-ты и 0,1 мл 1% р-ра нитрата серебра. При наличии хлоридов образуется белый творожистый осадок, растворимый в р-ре аммиака. 3) Испытание на нитраты и нитриты.Каплю диализата доб. к р-ру дифениламина в конц. серной к-те. При наличии нитратов или нитритов смесь окрашивается в синий цвет. Основное исследование диализата.
СЕРНАЯ КИСЛОТА.Диализат помещают в колбу и вносят в него медные опилки. Колбу соединяют с холодильником, снабженным аллонжем, конец кго опускают в рр йода в йодиде калия.Колбу с диализатом и медными опилками нагревают. Если р-р йода в приемнике обесцветится, его необходимо добавить дополнительно.В колбе с объектом происходит окислительно-восст. р-ция с образованием сернистой к-ты, к-я разлагается до оксида серы(IV).В приемнике также проходит ок.-восст. р-ция и наблюдается обесцвечивание йода.Обнаружение образовавшейся серной к-ты проводят с пом. след. реакций. 1) Р-ция обра-ния сульфата бария.К 3-5 каплям р-ра приб. 1-2 капли 5% р-ра хлорида бария. Появляется белый осадок, указывающий на наличие серной к-ты. 2) Р-ция получения сульфата свинца.К 3-5 каплям р-ра приб. 2-3 капли 3% р-ра ацетата свинца — выпадает белый осадок сульфата свинца, нераств. в азотной к-те, но раств. в р-рах щелочей и в растворе ацетата аммония.Последняя р-ция основана на спос-сти ионов свинца образовывать ацетатные ацидокомплексы. 3) Р-ция сродизонатом бария.К 1-2 мл р-ра доб. окрашенный в красный цвет 0,2% р-р родизоната бария. При наличии в р-ре сульфат-ионов окраска исчезает, р-р обесцвечивается и образуется белый осадок сульфата бария.Количественное определение серной к-тыпроводят методом алкалиметрии. Определенный объем диализата или отгона оттитровывают 0,1 М р-ром гидроксида натрия при индикаторе метилоранже.
АЗОТНАЯ КИСЛОТА.Перегонку диализата проводят, как в случае серной к-ты, в присутствии медных опилок. В приемник помещают очищ. воду. В реакционной колбе происходят реакции, приводящие к образованию оксидов азота.В приемнике оксид азота связывается с водой.Для обнаружения образовавшихся азотной и азотистой к-т исп-ют следующие р-ции. 1) Р-ция с дифениламином.В углубление на предметном стекле наносят 3-4 капли р-ра дифениламина в конц. серной к-те и приб. 1 кап. полученного в рез-те перегонки р-ра – появл. синее окраш..Эта реакция неспецифична. 2) Р-ция с бруцином.В углубление на предметном стекле помещают неск. капель исследуемого р-ра и приб. 2-3 капли бруцина в конц. серной к-те – появл. красное окраш. при наличии в диализате азотной к-ты. 3) Р-ция с белком на азотную к-ту (ксантопротеиновая проба).В часть исследуемого р-ра помещают белые шелковые, хлопчатобумажные и шерстяные нити и р-р выпаривают. Затем нити промывают водой. Шерстяные и шелковые нити окраш-ся в желт. цвет. При доб. р-ра аммиака окраска нитей переходит в оранж. Хлопчатобумажные нити остаются белыми. 4) Р-ция на азотистую к-ту.В пробирку вносят неск. капель исследуемого р-ра, приб. 2-4 капли 10% р-ра серной к-ты и 2-3 капли 1% водного р-ра феназона — наблюдают образование зеленого окрашивания.Количественное определение азотной к-тыпроводят методом нейтрализации. Определенный объем диализата или отгона титруют 0,1 М р-ром гидроксида натрия при индикаторе фенолфталеине.
ХЛОРОВОДОРОДНАЯ КИСЛОТА. Часть диализата помещают в колбу и нагревают на песчаной бане. Вначале из колбы отгоняется вода в приемник. Когда конц-ция хлористого водорода в реакционной колбе достигнет 10%, он начинает перегоняться и поступать в приемник, где растворяется в воде.Обнаружение хлороводородной к-ты проводят с помощью следующих р-ций.1) Р-ция с нитратом серебра.В пробирку помещают 1-2 мл р-ра, приб. 1-2 капли 5% р-ра нитрата серебра и 1 мл 10% азотной к-ты — появляется белый осадок, растворимый в р-ре аммиака и появляющийся вновь после подкисления р-ра азотной к-той.2) Р-ция выделения йода.В пробирку помещают 1 мл р-ра, приб. неск. кристалликов калия хлората и нагревают. В верхнюю часть пробирки помещают несколько йодкрахмальных бумажек. При наличии хлороводородной к-ты йодкрах-мальные бумажки синеют.Количественное определениехлороводородной к-ты проводят по методу Фольгарда в определенном объеме диализата или отгона.Если в исследуемом р-ре присутствует сероводород, для колич. определения хлороводородной к-ты исп-ют гравиметрический метод. С этой целью к р-ру доб. избыток нитрата серебра. При этом в осадке образуются хлорид серебра (AgCl) и сульфид серебра (Ag2S). Осадок отфильтровывают, обрабатывают 10% р-ром аммиака для растворения хлорида серебра. Аммиачный р-р подкисляют азотной к-й и полученный осадок хлорида серебра отфильтровывают, высушивают до постоянной массы и взвешивают.
Исследование диализата на нитриты и натраты.
НИТРИТЫ. 1) Р-ция с сульфаниловой к-той и β-нафтолом.В углубление на предметном стекле помещают 2 капли предварительно нейтрализованного диализата, приб. 2-3 капли 0,5% р-ра сульфаниловой к-ты в 2% р-ре хлороводородной к-ты. Через 3-5 мин к смеси приб. 1 каплю щелочного р-ра β-нафтола — появляется интенсивная оранжево-красная окраска. 2) Р-ция с реактивом Грисса (смесь сульфаниловой к-ты и 1-нафтиламина).В углубление предметного стекла вносят неск. капель нейтрализованного уксусной к-той диализата и при. 3-4 капли реактива Грисса. Через неск. мин. появл-ся интенсивная красная окраска.3) Р-ция с феназоном.К части диализата доб. 10% р-р серной к-ты и неск-ко капель 1% р-ра феназона — наблюдают появление зеленого окраш.
С помощью указанных р-ций м. б. обнаружены эндогенные нитриты. Поэтому исп-ют дополнит. перегонку диализата после подкисления уксусной к-той. Дистиллят должен давать те же р-ции на нитриты. Методика не позволяет обнаружить следовые кол-ва естественно содержащихся нитритов.
НИТРАТЫ. Перед обнаружением в диализате нитратов нитриты д. б. удалены с помощью азида натрия — NaN3 или сульфаминовой к-ты — NH2SО3H. После этого проводят реакции:1)С дифениламином в серной к-те с получением синего окрашивания.2)С сульфатом железа(II). В пробирку помещают часть исследуемого р-ра (обычно 2-3 капли) и кристаллик сульфата железа(II). Затем по стенке пробирки медленно приливают каплю конц. серной к-ты. На месте соприкосновения двух ж-стей появл. бурое кольцо. Нитраты восст0ся до оксида азота(II), к-й с избытком сульфата железа(II) образует р-р бурого цвета.
Исследование диализата на едкие щелочи. Анализ на едкие щелочи и аммиак проводится при сильно щелочной реакции водных вытяжек из био. материала и отсутствии карбонатов по предварительным пробам.
ГИДРОКСИД НАТРИЯ. 1) Р-ция с гидроксостибиатом калия.При потираний стенок пробирки стеклянной палочкой выпадает белый крист. осадок.2) Реакция с цинк-уранилацетатом.При наличии ионов натрия с уранилацетатом в нейтральных и уксуснокислых р-рах образуется зеленовато-желтый крист. осадок в виде октаэдров и тетраэдров.
ГИДРОКСИД КАЛИЯ. 1) Р-ция с гидротартратом натрия.Стенки пробирки потирают стеклянной палочкой. При наличии ионов калия выпадает белый осадок. 2) Р-ция с кобальтинитритом натрия.При наличии ионов калия выпадает желтый кристаллический осадок.
АММИАК. 1) Р-ция с реактивом Несслера.В присутствии аммиака выпадает желто-бурый или оранжево-коричневый осадок.Реакция неспецифична, так как многие ионы могут давать осадки в присутствии щелочи или реагировать с йодид-ионами, образуя подобную окраску.
Количественное определение едких щелочей и аммиака.Определенный объем диализата титруют 0,1 М раствором хлороводородной кислоты в присутствии индикаторов — фенолфталеина (для гидроксидов калия и натрия) и метилового оранжевого (для аммиака).
Видео:Коррозия металлов и меры по ее предупреждению. 8 класс.Скачать

4 Группа веществ, изолируемых минерализацией
3. Группа веществ, изолируемых минерализацией («МЕТАЛЛИЧЕСКИЕ ЯДЫ»
В данной главе дана общая характеристика группы (выделен перечень «металлических ядов», подлежащих обязательному судебно-химическому исследованию). Показана зависимость отравлений соединениями тяжелых металлов и мышьяка от экологии окружающей среды
Рассмотрены методы изолирования соединений тяжелых металлов и мышьяка из биологических образцов (сухое озоление, влажное озоление). Разграничены общие и частные методы изолирования, определены достоинства и недостатки. Показана техника проведения минерализации концентрированными кислотами.
Рассмотрен дробный метод анализа как основной анализ для определения металлических ядов. Показана сущность метода, его особенности, принципы и способы разделения ионов металлов (жидкость-жидкостная экстракция хелатов металлов, ионных ассоциатов, реакции осаждения, комплексообразования и пр.).
Определено место органических реагентов в дробном методе анализа. Дана характеристика реагентов, рассмотрены условия проведения реакций, химизм.
Показаны методы количественного определения металлов.
Подробно рассмотрено дробное обнаружение, определение и токсикологическое значение отдельных катионов.
Показаны современные методы разделения и определения ионов металлов. Кратким обзором показано использование атомно-абсорбционной спектроскопии и других спектральных методов при определении «металлических ядов».
3.1. ОБЩАЯ ХАРАКТЕРИСТИКА ГРУППЫ
Видео:ФОНД ПЕДАГОГИЧЕСКОГО НАСЛЕДИЯ. З.М. Лунева. Судебная танатологияСкачать
Рекомендуемые файлы
Группа веществ, изолируемых минерализацией, включает в себя так называемые «металлические яды» В настоящее время одной из актуальнейших проблем является ухудшение здоровья населения в связи с различными вредными факторами окружающей среды. Осложнение экологической обстановки приводит к увеличению суммарной токсикогенной нагрузки на человека. Одним из наиболее неблагоприятных факторов является загрязнение окружающей среды тяжелыми металлами. Важнейшими в токсикологическом отношении «металлическими ядами» являются соединения Ва, Bi, Cd, Mn, Cu, Hg, Pb, Ag, Tl, Cr, Zn, которые, попадая в организм человека, вызывают отравления. Правилами судебно-химического исследования при проведении ненаправленного анализа предусмотрено обязательное исследование на указанные элементы.
Как известно, практически все металлы естественным образом содержатся в человеческом организме. Причем содержание элементов в норме в органах человека сильно варьирует: например, содержание мышьяка в 100 г печени равно 0,01 мг, а содержание цинка может достигать 14,5 мг. Поэтому при судебно-медицинской оценке результатов судебно-химического исследования на «металлические яды» особое значение придается их количественному определению. Ввиду незначительных количеств этих элементов их называют микроэлементами. Они играют важную роль в физиологических процессах в организмах людей и животных. Так, например, кобальт входит в состав витамина BI2 и некоторых ферментов, медь участвует в синтезе гемоглобина; медь, кадмий, цинк входят в состав около 60 ферментов. Содержание микроэлементов в организме можно прокомментировать следующими данными: магний обнаруживается в организме в количестве 0,04%, медь — 0,005%, марганец -0,02%, молибден, цинк — в следовых количествах. В литературе не приведены данные о наличии и роли в организме соединений бария, висмута, сурьмы и таллия.
Не всегда возможно установить различие между жизненно необходимыми и токсичными металлами. Все металлы могут проявить токсичность, если они потребляются в избыточном количестве. Несмотря на важную положительную роль, которую играют микроэлементы в жизнедеятельности человека, например медь или цинк, при избыточном поступлении их с пищей или какими-либо другими путями может наступить тяжелая интоксикация, признаками которой являет тошнота, рвота, диарея, боли в животе. Кроме того, токсичность металлов проявляется в их взаимодействии друг с другом. Например, физиологическое воздействие кадмия на организм, в том числе его токсичность, зависят от количества присутствующего цинка, селена, а функции железа в клетках определяются присутствием меди, кобальта и в некоторой степени молибдена и цинка.
Негативное действие «металлических ядов» на организм человека проявляется в их выраженном нейротоксическом действии. Токсичность объясняется тем, что в организме они связываются с функциональными группами белков, аминокислот, пептидов и других жизненно важных веществ, в результате чего нарушаются нормальные функции клеток тканей. Образующиеся в организме комплексы металлов очень прочные, поэтому изолировать металлы и обнаружить их невозможно без предварительного разрушения органического вещества, с которым они связаны. Для этого применяются методы минерализации.
По вопросу металлических загрязнений существует несколько точек зрения. Согласно одной из них металлы периодической системы делят на 3 группы: металлы как незаменимые факторы питания (эссенциальные макро- и микроэлементы); неэссенциальные или необязательные для жизнедеятельности металлы; токсические металлы. Согласно другой точке зрения все металлы необходимы для жизнедеятельности, но в определенных количествах. Эта точка зрения выражается формулой: «Все вещества токсичны, но отсутствие веществ также вредно».
По воздействию на организм человека металлы классифицируют следующим образом:
1) металлы, необходимые при питании человека и животных (Со, Сu, Cr, Ge, Fe, Mn, Mo, Ni, Se, Si, V, Zn).
2) металлы, имеющие токсикологическое значение (As, Be, Cd, Cu, Co, Cr, Hg, Mo, Ni, Pb, Pd, Se, Sn, Ti, V, Zn).
При этом следует отметить, что 10 из перечисленных элементов отнесено к обеим группам.
Биологически эссенциальные металлы имеют пределы доз, определяющих их дефицит, оптимальный уровень и уровень токсического действия. Токсические металлы в низких дозах не оказывают вредного действия и не несут биологических функций, однако в высоких дозах оказывают токсическое действие. Тем не менее, существуют металлы, которые проявляют сильно выраженные токсикологические свойства при самых низких концентрациях и не выполняют какой-либо полезной функции. К таким токсичным элементам относят ртуть, кадмий, свинец, мышьяк. Они не являются ни жизненно необходимыми, ни благотворными, но даже в малых дозах приводят к нарушению нормальных метаболических функций организма.
Ртуть, кадмий, свинец, мышьяк, медь, стронций, цинк, железо Объединеная комиссия ФАО/ВОЗ по пищевому кодексу (Codex Alimentarius) включила в число компонентов, содержание которых контролируется при международной торговле продуктов питания. В России и СНГ подлежат контролю еще 6 элементов (сурьма, никель, хром, алюминий, фтор, йод), а при наличии показаний могут контролироваться и некоторые другие металлы. Медико-биологическими требованиями СанПиН 1078-01 определены критерии безопасности для следующих металлов: свинец, кадмий, ртуть, медь, цинк, олово, железо.
Несмотря на широкое распространение d-элементов в природе (в рудах, почве, воде и воздухе), их суммарное содержание в тканях и органах человека в норме не превышает 10-2 % массы тела. С точки зрения токсического воздействия металлов на организм наибольшую опасность представляет постоянно возрастающее антропогенное загрязнение окружающей среды, включая биоту
Элементы с неизвестной биологической ролью, но постоянно присутствующие в организме, называются примесными. Уровень примесных элементов может колебаться в пределах нескольких порядков. Для этих элементов, как правило, достоверно установлена токсичность.
Деление элементов на необходимые и примесные в определенной мере условно. Это объясняется прежде всего тем, что неорганические соединения различных элементов имеют широкий спектр биологической активности. И дефицит, и избыток жизненно необходимого элемента наносят вред организму. При дефиците необходимого элемента организму наносится существенный ущерб, например, из – за неактивности ферментов.
Оценка нормы содержания элементов, необходимость которых пока не доказана, возможна при определении примесных элементов в организме сельских жителей, меньше подвергающихся антропогенным влияниям окружающей среды. Полученные результаты используют как нормативные и сравнивают с ними токсическую нагрузку на организм в промышленных регионах. Например, были обнаружены близкие уровни свинца, бария, кадмия, стронция, мышьяка в костной ткани (эпифиз бедренной кости) жителей разного возраста и обоего пола, проживающих в одном из регионов Подмосковья.
У жителей промышленных регионов с возрастом увеличивается содержание некоторых примесных элементов, особенно у рабочих крупных металлургических и гальванических предприятий. Например, содержание кадмия, бария, свинца и стронция в образцах костной ткани более чем у 3000 человек, проживавших в разных районах Российской Федерации, различалось в сотни раз. Наименьшие колебания и самый низкий уровень этих элементов отмечены у жителей сельской местности.
Накопление металлов в организме может быть вызвано природными факторами (эндемические провинции) или техногенными загрязнениями.
3.2. ТОКСИДИНАМИКА И ТОКСИКОКИНЕТИКА МЕТАЛЛИЧЕСКИХ ЯДОВ
Механизм токсического действия соединений тяжёлых металлов, а также мышьяка и сурьмы, складывается из местного и резорбтивного эффектов. Местное действие проявляется в деструкции ткани и зависит от способности этих соединений к диссоциации. В результате уплотнения и денатурации белка образуется некроз тканей со струпом. Кислотный остаток (анион) сильной кислоты (хлороводородной, азотной) в составе молекулы металлического яда приводит к более выраженному деструктивному действию, чем действие соединений с кислотным остатком слабой кислоты (уксусной, угольной и др.).
В основе резорбтивного действия лежит блокирование функционально активных групп белков–ферментов, структурных белков и вытеснение специфического металла в металлсодержащих ферментах.
Функции рецепторов могут выполнять сульфгидрильные, гидроксильные, карбоксильные, амино- и фосфорсодержащие группы белковых и других жизненно важных соединений в организме. Свойствами рецепторов также могут обладать некоторые аминокислоты, нуклеиновые кислоты, ферменты, витамины, гормоны и ряд других веществ.
В зависимости от химического строения и свойств ядовитых металлов и соответствующих им рецепторов прочность химической связи между ними может быть различной. Взаимодействие рецепторов с ядовитыми веществами может осуществляться за счёт образования ковалентных, ионных, ион — дипольных и водородных связей, а также за счёт сил Ван–дер–Ваальса. Из этих связей наиболее прочными являются ковалентные. Непрочными являются ионные связи, затем водородные, а менее прочными являются связи, обусловленные силами Ван-дер-Ваальса.
Отравление солями тяжёлых металлов и другими неорганическими веществами обусловлено связыванием катионов указанных соединений с сульфгидрильными группами (рецепторами), содержащимися в молекулах белков. Связь между катионами некоторых металлов и сульфгидрильными группами является довольно прочной (ковалентной). Сульфгидрильные группы белковых веществ особенно прочно связываются с ионами мышьяка, сурьмы, ртути, висмута и некоторых других металлов.
В результате потери протеидами многих физико-химических и биологических свойств нарушается белковый, углеводный и жировой обмен. Разрушается структура клеточных оболочек, что приводит к выходу из клеток калия и проникновение внутрь натрия и воды.
Соединения тяжёлых металлов, а также мышьяка и сурьмы избирательно токсичны в основном для специфического эпителия почек, печени, кишечника, эритроцитов и нервных клеток, где наблюдается повышенная концентрация этих веществ.
Соединения тяжёлых металлов, мышьяка и сурьмы могут поступать в организм пероральным, ингаляционным путём, через кожу и слизистые оболочки, при парентеральном введении.
Основной путь поступления — пероральный. При попадании в желудочно-кишечный тракт (ЖКТ) эти вещества всасываются в ионизированном виде, чему способствует присутствие хлоридов в желудочном соке и щелочная реакция кишечного сока.
Всасывание из ЖКТ является суммой сложных реакций, в процессе которых соединения металлов могут подвергаться разнообразным превращениям, способствующим их проникновению через клеточные мембраны. Под влиянием пищеварительных соков может меняться форма всасывания соединений.
Всасывание металлов и неметаллов в ЖКТ происходит в разных его отделах и в различной степени, но преимущественно в верхнем отделе тонкой кишки.
В то же время, много металлов, которые мало или почти не сорбируются в пищеварительном тракте. Это обычно связано с образованием в последнем плохо растворимых соединений. Всасывание кадмия в пищеварительном тракте составляет менее 30 %.
Известную роль играет также форма, в которой минеральные соединения поступают в организм. Хорошо усваиваются соединения металлов из пищи, где они находятся обычно в виде комплексов с органическими соединениями.
Проникновение металлов и их соединений через кожу, как правило не имеет практического значения, хотя известно, что многие из них могут резорбтироваться этим путём. Однако определённую опасность интоксикации при всасывании через кожу могут оказывать металлы, такие как ртуть, таллий, хром и некоторые другие.
Ещё реже металлы попадают в организм ингаляционным путём. Такой путь поступления возможен в обычных условиях для паров ртути, либо для паров других металлов при плавлении. Таким же образом могут проникать в организм соединения металлов и других веществ, находящихся в аэрозолях и некоторых других формах.
Превращения. Металлы, неметаллы и их соединения в организме обычно переходят из одной формы в другую. Это происходит на всём пути пребывания яда в организме: всасывании, транспорте, распределении, выделении. Металлы, преимущественно с переменной валентностью, подвергаются в организме восстановлению и окислению. Так, 5-ти валентный мышьяк восстанавливается в организме до более токсичного 3-х валентного, 6-ти валентный хром — до 3-х валентного, легко вступающего в реакции комплексообразования с белками. Предполагается также восстановление в организме марганца и свинца. Металлическая ртуть, как известно, окисляется до одновалентной. Наибольшее разнообразие характерно при образовании комплексов.
Большую часть пребывания в организме металлы существуют в виде комплексов с белками, пептидами и аминокислотами.
Транспорт. Металлы и их соединения переносятся кровью и тканевой жидкостью в различном состоянии. Хорошо растворимые соли металлов находятся в крови в истинном водном растворе, то есть в виде ионов, однако, в том случае, если диссоциация идёт не до конца, в крови одновременно присутствуют ионы (катионы) и нейтральные молекулы. В ионной форме циркулируют в крови и тканевой жидкости определённая часть бария, марганца, свинца и ртути.
Для большинства металлов характерна циркуляция, как в свободном, так и в связанном состоянии с разнообразными биокомплексонами. Особенно велика транспортная роль плазменных белков, обратимо связывающих многие металлы.
В транспорте многих металлов и неметаллов большую роль играет их способность накопления в клетках крови, главным образом, в эритроцитах. В эритроцитах находится почти весь мышьяк крови, значительная часть селена, основная часть свинца.
Длительная циркуляция в крови определяется формой, в которой находится металл. Свободные ионы очень скоро удаляются из крови, крупные коллоидные — также быстро захватываются ретикуло-эндотелиальной системой, в основном, печени и селезёнки, дисперсные коллоидные комплексы циркулируют в крови значительно дольше.
Распределение. На пути проникновения в клетки металлы преодолевают ряд пограничных мембран. По современным представлениям клеточные мембраны имеют белково-липидную структуру и активно участвуют в процессах транспорта и обмена веществ, благодаря присоединению к ним ряда энзимных систем. Перенос металлов в виде катионов осуществляется при помощи ферментных систем, включённых в структуру мембран.
Распределение металлов по органам и тканям в известной мере определяется физико – химическими свойствами, образующихся в крови соединений. Крупные коллоидные частицы, как упоминалось, захватываются ретикулоэндотелиальной системой печени, селезёнки, почек, костного мозга, где они временно задерживаются. Несравненно более прочным депо является скелетная система, где, как правило, откладываются металлы, поступающие преимущественно в виде хорошо растворимых соединений.
Избирательное накопление металлов в некоторых органах объясняется большим содержанием в них лигандов, с которыми металлы образуют комплексы. Таким критическим органом для ртути, кадмия и таллия являются почки, белки которых богаты тиоловыми группами. Относительно высокое содержание многих металлов в железах внутренней секреции связано с интенсивным кровоснабжением и специфическими функциями.
Выделение. При вдыхании аэрозолей металлов выделение последних происходит при помощи мерцательного эпителия верхних дыхательных путей и фагоцитов, в основном до резорбции в кровь.
Выделение из организма металлов и их соединений происходит, в основном, через почки и ЖКТ. Наиболее быстро выделяются металлы, находящиеся в ионной форме, затем лабильно связанные и, в последнюю очередь, – фракция металлов, образующих прочные комплексы. Путь преимущественной элиминации резорбированного металла через почки или ЖКТ в определённой степени зависит от формы его циркуляции и депонирования. Металлы, находящиеся в крови в молекулярно – дисперсном состоянии, в виде ионов или в виде слабых комплексов, выделяются преимущественно с мочой. Это, в первую очередь, щелочные металлы. Выше упоминалось, что многие тяжёлые металлы, в том числе свинец, марганец, ртуть и др. частично циркулируют в крови и тканевой жидкости в виде ионов и слабых комплексов и образуют в тканях лабильные соединения. Таким образом, даже тяжёлые металлы, выделение которых происходит в основном через пищеварительный тракт, частично элиминируют и через почки.
Преимущественно экскретируются с мочой некоторые металлы, откладывающиеся в значительных количествах в почках, хотя это не является общим правилом. Как показано на примере многих радиоактивных изотопов, металлы, откладывающиеся преимущественно в печени, характеризуются низким выделением с мочой и высоким – через кишечник.
Выделение из мягких тканей, как правило, происходит значительно быстрее, чем из скелета.
При попадании в организм человека или животного высоких доз соединений металлов, а также мышьяка и сурьмы, происходит их связывание со многими биологически активными веществами организма, что приводит к нарушению протекания биохимических и физиологических процессов. В ряде случаев это заканчивается не только тяжёлыми отравлениями, но и смертью пострадавшего.
Как уже отмечалось выше, в организме «металлические» яды образуют с белками, пептидами, аминокислотами и некоторыми другими веществами очень прочные комплексы. Чтобы обнаружить металлы, необходимо разрушить органические вещества, содержащиеся в исследуемых объектах, и перевести «металлические» яды в ионное состояние. Для этой цели используется окисление (сжигание) органического вещества, составляющего объект исследования, которое приводит к освобождению искомых неорганических веществ. Вероятно, поэтому процесс окисления называется минерализацией.
Объектами исследования на «металлические яды» являются органы и ткани организма человека, чаще всего это печень, почки, желудок и др. Количество исследуемого материала зависит от общей массы объекта, от обстоятельств дела и других факторов. В среднем навеска биоматериала составляет 100 г. Минерализацию разнохарактерных объектов проводят отдельно, не смешивая. Это необходимо для получения объективных результатов анализа и правильной судебно-медицинской оценки.
Минерализация — это окисление (сжигание) органического вещества (объекта) для освобождения металлов из комплексов с белками и другими соединениями. Наиболее широко распространенные методы минерализации можно разделить на 2 большие группы:
1. Частные методы (методы сухого озоления) — минерализация путем простого сжигания или сплавления со смесью нитратов и карбонатов щелочных металлов. К числу частных методов относится и метод частичной минерализации (деструкция), служащий для изолирования ртути из биологических объектов.
Метод простого сжигания основан на нагревании органического вещества (объекта) при высокой температуре при доступе воздуха. Сухое озоление проводят в фарфоровых, платиновых или кварцевых тиглях. На исследование берут небольшие навески (1-3 г), температура нагревания достигает 300-400 ° С. Метод применяется при специальных заданиях по обнаружению катионов марганца, меди, цинка, висмута, особенно в тех случаях, когда объект либо очень эластичен, трудноразрушаем, либо его количество ограничено. Метод имеет определенные недостатки:
1. При нагревании возможно улетучивание металлов в виде солей или в индивидуальном виде, т.к. при нагревании в условиях проведения сухого озоления не всегда удается контролировать температуру. Даже при относительно невысокой температуре улетучиваются соединения ртути и таллия, а при температуре свыше 400 °С — хлориды кадмия, свинца, серебра, цинка, марганца, мышьяка.
2. Возможно взаимодействие некоторых металлов с материалом тигля, например, цинк, свинец, серебро могут реагировать с кварцем и фарфором, а кобальт может сплавляться с платиной.
Метод сплавления с нитратами щелочных металлов в химико-токсикологическом анализе применяется чаще, чем сухое озоление. Биологический материал нагревают с расплавленными нитратами щелочных металлов. Но с чистыми нитратами окисление идет очень быстро, особенно при повышенных температурах, при этом может наблюдаться выбрасывание пробы из тигля. Поэтому, для предотвращения бурного протекания реакции при сплавлении применяют смесь нитратов с карбонатами щелочных металлов.
2. Общие методы (методы мокрой минерализаци) применяются при общем (ненаправленном) исследовании на группу металлических ядов, пригодны для изолирования всех катионов металлов, кроме ртути. Для минерализации используют смеси кислот — окислителей (серной и азотной, серной, азотной и хлорной), а также калия хлорат и пергидроль. Под действием окислителей происходит разрушение биологического материала с образованием более простых химических соединений. При этом связи между металлами и биологическими субстратами организма (белками, аминокислотами и др.) разрушаются, образуются соли этих металлов, которые можно обнаружить в минерализате при помощи соответствующих реакций и методов.
3.3.1.Методы мокрой минерализации
Первый метод минерализации биологического материала при химико-токсикологических исследованиях с использованием в качестве окислителя концентрированной кислоты азотной предложил русский ученый Нелюбин А.П. Этот метод сыграл большую роль в развитии химико-токсикологического анализа. Однако разрушение биологического материала при нагревании с концентрированной HNO3 требует большой затраты времени, реагент слабо окисляет жиры. В дальнейшем в качестве окислителя использовалась концентрированная кислота серная, действующая одновременно и как дегидратирующий агент. Однако, этот процесс тоже был весьма продолжительным по времени, и в процессе минерализации образовывались неразлагающиеся обуглившиеся остатки. Для устранения этих недостатков в 1821 году М.Ж.Орфила предложил применять смесь концентрированных серной и азотной кислот. Этот метод был модифицирован и применен для целей химико-токсикологического анализа в 1908 году П.К. Равданикисом. До настоящего времени этот, метод находит применение в практике Бюро СМЭ и является по сути дела основным методом минерализации.
Метод минерализации смесью концентрированных серной,
азотной кислот и воды (1:1:1)
Процесс разрушения биологического объекта протекает в 2 стадии:
1. Стадия деструкции, на которой происходит разрушение биологических субстратов организма (белков, жиров, углеводов) на составные части: белки разрушаются до аминокислот, углеводы (полисахариды) до ди- и моносахаридов жиры до глицерина и жирных кислот. Менее всего подвержены разрушению на первой стадии жиры. На первой стадии нагревание не должно быть сильным, чтобы избежать подгорания объекта или сильного пенообразования и выброса частиц объекта из колбы. Поэтому, в начале процесса колбу Къельдаля закрепляют над плиткой на расстоянии 1-2 см. Температура не должна превышать 110°С. Эта стадия непродолжительна по времени, длится от 15 до 40 минут. По окончании деструкции получается прозрачная желтовато-бурая жидкость, иногда с пленкой жира, т.к. на этой стадии все элементы объекта разрушены, кроме жиров.
На стадии деструкции концентрированная H2SO4 выполняет роль водоотнимающего средства, что приводит к нарушению структуры клеток и тканей, деформирует их. При этом она способствует повышению температуры кипения смеси и тем самым повышает окислительное действие концентрированной HNO3.
Роль окислителя на первой стадии выполняет концентрированная HNO3.
Кислота азотная, свободная от окислов азота, что наблюдается в самом начале минерализации, почти инертна. Под влиянием индуцирующих веществ в процессе окисления биоматериала часть кислоты азотной разлагается до кислоты азотистой и оксидов азота, которые являются катализаторами окисления. Под их влиянием и с повышением температуры азотная кислота проявляет себя как сильный окислитель. Идет интенсивный автокаталитический процесс окисления органических веществ:
2. Стадия глубокого жидкофазного окисления. Колбу Къельдаля опускают на плитку и усиливают нагревание. На этой стадии происходит окончательное разрушение органических веществ. Полностью разрушаются и жиры, которые на первой стадии почти не пострадали под действием кислоты азотной. В процессе окисления необходимо по каплям постоянно добавлять в колбу разведенную кислоту азотную из капельной воронки, но при этом скорость добавления реактива должна быть такова, чтобы бурые пары окислов азота, образующиеся при минерализации, не выходили из колбы. Эта стадия длится 3-4 часа и считается законченной тогда, когда:
— начинает выделяться белый туман (пары SО2);
— жидкость остается бесцветной;
-минерализат не темнеет в течение 30 минут без добавления кислоты азотной.
Роль окислителя на этой стадии играет концентрированная кислота серная (её концентрация повышается в смеси до 60-70%, температура превышает 110 °С). Она разлагается с выделением оксида серы (IV) и активного кислорода.
В процессе минерализации происходит не только разрушение органических веществ, но и ряд побочных реакций, имеющих негативное значение:
А) Кислота серная в высоких концентрациях сульфирует органические вещества, а кислота азотная, особенно в присутствии кислоты серной, — нитрует их. Сульфо- и нитросоединения очень прочные, трудно поддаются воздействию окислителей, что влечет за собой неполное разрушение биообъекта. Эти негативные процессы можно значительно уменьшить. Это достигается использованием не концентрированных кислот, а частично разбавленных добавлением в окислительную смесь воды (вспомните соотношение реагентов в окислительной смеси). При разбавлении Н2SO4 и HNO3 водой степень нитрования — сульфирования значительно снижается.
Б) Ещё одна побочная реакция связана с образованием нитрозилсерной кислоты при взаимодействии оксидов азота с концентрированной серной кислотой.
Нитрозилсерная кислота очень устойчива к температуре, однако легко гидролизуется. Реакция гидролиза обратима.
Нитрозилсерная кислота является источником окислителей в минерализате, что мешает в дальнейшем обнаружению некоторых катионов металлов. Чтобы избавиться от негативного воздействия нитрозилсерной кислоты, её удаляют путем проведение денитрации.
1. Сравнительно быстрое достижение полноты разрушения органических веществ.
2. Полнота разрушения объекта обусловливает большую чувствительность методов анализа катионов металлов.
3. Малый объем получаемого минерализата, что также повышает чувствительность методов анализа.
Основным недостатком метода являются большие потери Нg (до 90-98%) за счет её летучести. Поэтому изолирование ртути в виде ионов проводят в отдельной навеске биообъекта частным методом изолирования, который исключает использование высоких температур, процесс ведется в присутствии катализатора (этанола).
Метод минерализации смесью серной, азотной и хлорной кислот (1:1:1)
Кислоту хлорную в качестве окислителя в аналитической химии впервые применил А.Щербак в 1893 году.
В качестве окислительной смеси при изолировании этим методом используют смесь из равных объемов концентрированной H2SO4 и концентрированной HNO3 и 37% или 42% НСlO4. Методика выполнения изолирования аналогична первому методу, однако второй метод имеет ряд несомненных достоинств:
1. Высокая скорость минерализации, сокращение в 2-3 раза затрат времени в сравнении с первым методом.
2. Очень высокая степень окисления органических веществ (до 99 %), что обусловлено способностью хлорной кислоты разрушать вещества стойкие или медленно разлагающиеся другими окислителями.
3. Окисление большинства поливалентных металлов до высших степеней окисления.
4. Небольшой расход окислителей.
5. Малый объем получаемого минерализата, что повышает чувствительность методов анализа.
Основной недостаток тот же, что и у первого метода – практическая полная потеря ртути. Однако есть еще одна опасность при использовании кислоты хлорной в составе окислителей — это взрывоопасность и токсичность хлорной кислоты. Безводная кислота хлорная нестойкая, может взрываться при хранении при повышенной температуре или при соприкосновении с некоторыми органическими соединениями. Это требует соблюдения особых мер предосторожности при работе с кислотой хлорной.
При любом способе минерализации следует соблюдать меры предосторожности, т.к. возможны термические ожоги, выбрасывание горячих кислот из колб и даже взрывы (особенно при использовании в качестве окислителей пергидроля, хлорной кислоты и хлората калия). Поэтому следует пользоваться защитными очками, работать в вытяжных шкафах с хорошей тягой.
Нельзя не остановиться ещё на одном очень важном этапе исследования «металлических ядов» — проверке чистоты реактивов. Недостаточно чистые кислоты — окислители могут загрязнять минерализаты соединениями металлов, при этом количество примесей может оказаться весьма значительным, что послужит основанием для ошибочного заключения о наличии «металлических ядов в биоматериале и причине отравления. Чтобы исключить ошибку, необходимо применять кислоты, свободные от примесей. Если степень их чистоты неизвестна, то проводят «холостой опыт», т.е. берут реактивы в нужных для методики количествах и полностью воспроизводят её. Только при отрицательных эффектах реакций обнаружения металлов, делают вывод о пригодности кислот для использования в процессе минерализации.
Независимо от того, каким методом проводилась минерализация биологического материала, минерализат в большинстве случаев содержит окислители, которые помешают дальнейшему проведению анализа. Это азотная, азотистая кислоты, оксиды азота, нитрозилсерная кислота. Для их удаления используются методы денитрации. Применяемые ранее гидролизный метод, метод денитрации мочевиной, натрия сульфитом практически вытеснены методом денитрации формальдегидом. Метод предложен в 1952 году Т.В.Зайковским. Процесс денитрации заканчивается за 1-2 минуты, избыток непрореагировавшего формальдегида легко удаляется при нагревании в течение 5-10 минут. Для проверки полноты денитрации минерализата проводят реакцию с дифениламином в среде концентрированной кислоты серной.
Полученную после минерализации жидкость, в которой металлы находятся в виде сернокислых солей, разбавляют водой до определенного объема в мерной колбе (200мл) и используют для проведения качественного анализа «дробным» методом и количественного определения.
3.3.2. Методика изолирования металлических ядов из биологического материала общим методом минерализации
100 г биологического объекта в колбе Къельдаля заливают 75 мл окислительной смеси (кислоты серной концентрированной, кислоты азотной концентрированной, воды дистиллированной в соотношении 1:1:1). Колбу закрепляют в штативе вертикально на расстоянии 1-2 см от асбестовой сетки. Над колбой помещают капельную воронку с разбавленной азотной кислотой (1:1). Колбу осторожно взгревают на плитке, добавляя при необходимости (потемнение жидкости) разбавленную азотную кислоту (1:1) по каплям до просветления жидкости. Концом минерализации считается момент, когда в колбе остается 15-20 мл бесцветной или окрашенной жидкости, которая не темнеет в течение 30 минут при постоянном нагревании, без добавления кислоты азотной. Охлажденный минерализат осторожно выливают в химический стакан, содержащий 30 мл дистиллированной воды, колбу Къельдаля ополаскивают два раза дистиллированной водой по 10мл и присоединяют промывные воды к разбавленному минерализату. Разбавление минерализата способствует затем более легкому протеканию процесса денитрации.
В маленькой фарфоровой чашке в 2-3 каплях концентрированной кислоты серной растворяют 2-3 кристалла дифениламина и к полученному бесцветному раствору прибавляет одну каплю разбавленного минерализата. В случае появления сине-голубого окрашивания проводят денитрацию раствора.
Стакан с содержимым ставят на плитку, нагревают до кипения и вносят одну каплю формалина; кипятят 10 минут и вновь проделывают реакцию дифениламином.
4 HNO2 + 2 H2CO ® 2 NO + N2 + 2 CO2 + 4 H2O
4 HNO3 + 3 H2CO ® 4 NO + 3 CO2 + 5 H2O
4 HNO3 + 5 H2CO ® 2 N2 + 5 CO2 + 7 H2O
В случае отсутствия голубого окрашивания в результате реакции с дифениламином жидкость кипятят до исчезновения запаха формалина, охлаждают, количественно переносят в мерную колбу на 200 мл и доводят водой очищенной до метки. Жидкость из мерной колбы переносят в чистую сухую склянку и используют для обнаружения катионов (100 мл) и количественного определения (100 мл). Если при разбавлении минерализата водой выпадает осадок, то независимо от того, проводилась денитрация или нет, жидкость в стакане нагревают до кипения, кипятят 10 минут и оставляют стоять на сутки для получения более плотного осадка. На второй день белый кристаллический осадок отфильтровывают через плотный фильтр
В осадке после проведения минерализации могут находиться нерастворимые в воде сульфаты бария, свинца и кальция. Химико-токсикологический интерес представляют только барий и свинец, которые необходимо до обнаружения разделить.
Для этого осадок отфильтровывают через плотный фильтр, промывают 2 – 3 раза водой очищенной и присоединяют промывные воды к фильтрату, доводя его до метки в мерной колбе.
Осадок на фильтре 2 раза промывают водой, подкисленной 1 % раствором кислоты серной. Промывные воды отбрасывают. Затем осадок на фильтре многократно обрабатывают 5 мл горячего насыщенного раствора аммония ацетата, подкисленного кислотой уксусной (каждый раз нагревая фильтрат).
PbSO4 + 2 CH3COONH4 ® (CH3COO)2Pb + (NH4)2SO4
Этот, второй фильтрат, исследуют на ионы свинца, а осадок на фильтре – на ионы бария.
3.4. ДРОБНЫЙ МЕТОД АНАЛИЗА «МЕТАЛЛИЧЕСКИХ ЯДОВ»
Теоретические основы дробного метода анализа в аналитической химии были разработаны профессором Н.А.Тананаевым в 30-е годы прошлого века. Для целей судебно-химического анализа дробный метод разработала и внедрила А.Н.Крылова. Дробный метод полностью вытеснил ранее применявшийся систематический сероводородный метод.
Дробный метод предусматривает определение одних ионов металлов в отдельных небольших порциях исследуемого раствора в присутствии других без их предварительного разделения на группы, что достигается использованием соответствующих аналитических приемов и проведением анализа по определенной схеме, в которой обозначена последовательность обнаружения ионов.
Обнаружение искомых ионов дробным методом проводится в 2 этапа: вначале устраняется влияние мешающих ионов с помощью соответствующих приемов и реактивов, а затем, на втором этапе — прибавляют реактив, дающий какой-либо аналитический сигнал (окраску, осадок и др.) с открываемым ионом.
Дробный метод анализа особенно удобен в случаях с «лимитированными заданиями», т.е. когда задача эксперта ограничена заданием провести исследование только на определенные ионы или исключить тот или иной ион. Таким образом, дробный метод вполне удобен и экономичен, как нельзя лучше подходит для решения практических задач судебно-химической экспертизы.
Специфические особенности судебно-химического анализа на металлические яды:
1. Необходимость выделения из большого количества биологического объекта малых количеств (мг-мкг) веществ, которые могли послужить причиной отравления.
2. Необходимость исследования на сравнительно большую группу ядов (13 элементов), обладающих некоторой общностью химических свойств (d-элементы).
3. Специфический характер объектов исследования. Ими чаще всего являются внутренние органы трупа, которые могут содержать в качестве естественных почти все химические элементы, известные как «металлические яды» (за исключением Ba, Bi, Sb, Tl). Поэтому всегда встает вопрос о количественном определении. Данные количественного анализа позволяют судебно-медицинским экспертам решать вопрос, являются ли найденные металлы введенными в организм или естественно содержащимися.
Учитывая специфические особенности судебно-химического анализа А.Н.Крылова при разработке дробного метода предъявила ряд требований, чтобы анализ был достаточно быстрым, надежным и экономичным:
1. Должна быть возможность сочетания качественного и количественного определения в одной навеске исследуемого органа на все токсикологически важные элементы (за исключением ртути, которая определяется в отдельной навеске навеске специфическим деструктивным методом).
2. Должна быть обеспечена высокая доказательность и надежность метода. Это достигается применением, как правило, не одной, а, по меньшей мере, двух реакций: основной и подтверждающей. В качестве основных чаще всего используются жидкофазные реакции образования окрашенных комплексов с различными реагентами, извлекаемых в слой органического растворителя (дитизонатов, диэтилдитиокарбаминатов, комплексов с 8-оксихинолином, красителями трифенилметанового ряда и др.). Большинство подтверждающих реакций — микрокристаллоскопические или осадочные.
3. Реакции должны быть высоко специфичными, чтобы определять катион в присутствии других. Однако абсолютно специфичных реакций очень мало, поэтому необходимо создавать селективные условия и устранять мешающее влияние посторонних ионов. Для этого разработаны следующие приемы:
— маскировка мешающих ионов. Осуществляется путем введения комплексообразователей, применения окислительно-восстановительных реакций и др.;
-строгое соблюдение определенных значений рН среды при проведении реакций;
-селективная экстракция металлов в органический растворитель в виде комплексов или ионных ассоциатов с последующей реэкстракцией ионов металлов в водную фазу.
4. Реакции должны быть высокочувствительны, но не должны открывать естественно содержащиеся количества элементов. Поэтому для выполнения реакций на отдельные катионы объем минерализата строго лимитирован. Кроме того, применяют прием разбавления минерализата до пределов чувствительности реакции. При этом снижается влияние мешающих ионов и концентрация кислот, исключается обнаружение большинства естественно содержащихся элементов.
5. Методики, разработанные для обнаружения «металлических ядов» быть простыми, доступными, а их проведение не требовать больших затрат времени на анализ, и дорогостоящего оборудования и реагентов.
Таким, образом, А.Н.Крылова рассматривает дробный метод обнаружения «металлических ядов» как сумму отдельных наиболее характерных и чувствительных реакций на катионы. Дробный метод разработан на 13 наиболее важных в токсикологическом отношении элементов. Он обязательно сочетается с параллельно проводимым частным методом обнаружения и количественного определения иона ртути после деструкции отдельной навески биоматериала.
При составлении схемы проведения дробного анализа необходимо учитывать ограниченную специфичность отдельных реакций:
1. Чувствительность реакций на хром и марганец снижается при большом количестве в минерализате хлорид-ионов, поэтому исследование на хром и марганец рекомендуется проводить до осаждения Аg в виде АgCl с помощью NaCI.
2. Обнаружению мышьяка мешает присутствие в минерализате катионов сурьмы, в связи с чем исследование на сурьму предшествует анализу на мышьяк.
3. Большие количества меди мешают обнаружению сурьмы по реакции образования её сульфида Sb2S3 (черный осадок CuS маскирует оранжевую окраску Sb2S3). Следовательно, в ряду катионов по схеме дробного анализа медь должна стоять раньше сурьмы.
Для повышения надежности обнаружения «металлических ядов» А.Н. Крылова предлагает определенный порядок их анализа в минерализате. А именно: свинец, барий, марганец, хром, серебро, медь, сурьма, таллий, мышьяк, висмут, кадмий. Параллельно проводится анализ на ртуть после деструкции отдельной навески органов (печень, почки).
3.4.1.Маскировка ионов в дробном анализе
Маскировка является одной из важнейших операций в дробном анализе.
Маскировкой называется процесс устранения влияния мешающих ионов находящихся в сложной смеси, для обнаружение искомых ионов. При маскировке мешающие ионы переводят в соединения, которые теряют способность реагировать с реактивами на искомые катионы. С целью маскировка используют следующие приемы: переводят мешающие ионы в устойчивые комплексы, изменяют валентность металлов при помощи окислителей и восстановителей, изменяют рН среды и др.
Основной способ маскировки в ХТА — комплексообразование. Для использования этого приема подбирается такой реактив, который с мешающими ионами образует бесцветные прочные комплексы, не способные реагировать с основным реактивом на искомый ион. Например, обнаружению ионов кадмия по реакции с сероводородом осадок CdS имеет ярко-желтую окраску) мешают ионы меди (осадок CuS имеет черное окрашивание). Для маскировки ионов меди прибавляют раствор цианида щелочного металла, при этом образуется бесцветный комплексный ион
[Сu (CN)4]2-. Реакция меди с сероводородом не пойдет.
Можно использовать и обратный прием — демаскировку ионов — это процесс освобождения ранее замаскированных ионов от маскирующих реагентов. В основном она осуществляется разложением полученных комплексных соединений. В результате ранее замаскированные ионы восстанавливают способность вступать в реакции с соответствующими реактивами.
Для маскировки в дробном анализе применяют следующие реактивы:
1. Цианиды (CN-)- образуют комплексы с Со, Сu, Zn, Fe, Cd, Hg, Ag. Цианиды применяются достаточно широко, при необходимости можно легко провести демаскировку ионов. Главное требование: их нельзя прибавлять к кислым растворам, т.к. может произойти разложение солей с выделением легко летучей синильной кислоты.
2. Фосфаты (PO43-) — применяются для связывания ионов Fe (III) при исследовании на Мn, Сr, Си.
3. Тиосульфаты(S2O82-) — применяются для маскировки ионов Cd (II) при анализе на Zn, a также Ag, Pb, Fe (III),Cu и др. ионы.
4. Тиомочевина((NH2)CS) — применяется для маскировки ионов Bi, Fe (III), Sb, Hg, Ag и др., с которыми образует прочные внутрикомплексные соединения.
5. Используются также фториды, трилон Б, кислота лимонная и её соли цитраты, кислота винная и её соли тартраты и др. комплексообразователи.
6. Гидроксиламин и кислота аскорбиновая используются для маскировки как восстановители.
3.4.2.Применение органических реагентов в дробном анализе
В дробном методе анализа широко применяются различные органические реагенты: диэтилдитиокарбаминаты натрия и свинца (в анализе на катионы меди, цинка, кадмия, висмута), дитизон (в анализе на катионы свинца, таллия, цинка, серебра, ртути), 8-оксихинолин (в анализе на катион висмута), малахитовый зеленый из группы трифенилметановых красителей (при анализе на катионы сурьмы и висмута), дифенилкарбазид (при анализе на катион хрома), тиомочевина (при анализе на катион висмута) и др. В основном, образуются окрашенные комплексные соединения или ионные ассоциаты. Ионные ассоциаты (ионные пары) представляют собой неполностью диссоциированные солеобразные соединения, образующиеся в результате ассоциации противоположно заряженных ионов, при этом характер связи колеблется от ионной (электростатической) до ковалентной.
Реакции с органическими реагентами используются для следующих целей:
1. Образование окрашенных комплексов служит качественным доказательством ряда катионов.
2. Окраска комплексов может использоваться для количественного определения катионов фотоэлектроколориметрическим методом.
3. Реакции могут использоваться для селективной экстракции (выделения) катионов в виде комплексов из минерализата с последующей реэкстракцией ионов в водную фазу и обнаружением их качественными реакциями.
3.4.3.Применение диэтилдитиокарбаминовой кислоты и её солей
Диэтилдитиокарбаминовая кислота — соединение, неустойчивое в водных растворах, поэтому в аналитической практике используют её натриевую, аммониевую, свинцовую соли. Эти реагенты образуют более чем с 20 металлами внутрикомплексные соединения – диэтилдитиокарбаминаты (ДДТК металлов). В большинстве случаев они используются для целей селективной экстракции катионов из минерализата.
Свойства ДДТК металлов
ДДТК металлов, за исключением ДДТК натрия, нерастворимы в воде, но хорошо растворяются в органических растворителях (хлороформ). Большинство ДДТК металлов — бесцветные соединения. Окраску имеют некоторые растворы комплексных соединений в хлороформе: ДДТК меди имеют яркое желто-коричневое окрашивание, ДДТК висмута, кадмия, сурьмы – бледно — желтое, хрома — бледно-зеленое.
ДДТК металлов образуются при строго определенных значениях pH среды. В щелочной среде образуются комплексы цинка (рН 8,5), кадмия (рН 12,5), висмута (рН 14). Оптимальным значением рН для образования ДДТК меди является рН 3, однако этот комплекс устойчив и в интервале рН от 4 до 11. Таким образом, регулируя рН раствора, можно избирательно изолировать из минерализата тот или иной катион.
Устойчивость ДДТК металлов также связана с рН среды; те комплексы, которые образуются в щелочной среде — неустойчивы в кислой и разрушаются под действием кислот. Это свойство используется для реэкстрации металлов из их комплексов и переведения в водную фазу с целью проведения подтверждающих реакций. Например, ДДТК цинка и кадмия можно разрушить действием кислоты хлористоводородной, а ДДТК висмута — азотной.
Для тех ДДТК металлов, которые устойчивы в широком интервале рН (медь), выделение катиона в водную фазу основано на использовании правила рядов среди диэтилдитиокарбаминатов. Согласно этому правилу каждый предшествующий катион, находящийся в водной фаз, вытесняет последующие катионы из их комплексов, растворенных в хлороформе.
Ряд ДДТК токсикологически важных катионов можно представить следующим образом:
Нg > Аg > Си > Ni > Со > Pb > Bi > Cd > Tl > Sb > Zn > Mn > Fe
Например, Нg 2+ способна вытеснять Си из (ДДТК)2Си, в свою очередь Си 2+
вытесняет Pb из (ДДТК)2 Pb.
Катионы цинка, кадмия, висмута и меди называют экстракционными катионами и их анализ проводят по следующей схеме:
1. Выделение из минерализата в виде комплекса с ДДТКК при определенном рН раствора и экстракция в органическую фазу.
2. Разрушение комплексов кислотами или по правилу рядов – реэкстракция — переведение катионов в водную фазу.
3. Обнаружение и количественное определение.
Дитизон (дифенилтиокарбазон), введен в аналитическую практику в 1957 году Фишером, который предписывает следующую структуру органического реагента. В зависимости от рН среды, дитизон может существовать в двух таутомерных формах: в кислой среде — в кетоформе, в щелочной среде — в енольной формe.
Кетонная форма Енольная форма
(в кислой и нейтральной среде) (в щелочной среде)
1. Дитизон в кетоформе хорошо растворим в органических растворителях и не растворим в воде. В хлороформе образует окрашенные в интенсивно зеленый цвет растворы. В енольной форме дитизон хорошо растворим в воде, но нерастворим в органических растворителях. На этом свойстве основано удаление избытка дитизона из дитизонатов металлов: полученный дитизонат промывают водным раствором аммиака — дитизонат в енольной форме переходит в водную фазу.
2. Большинство дитизонатов металлов — ярко окрашенные соединения растворимые в органических растворителях и нерастворимые в воде Дитизонаты серебра и ртути имеют золотисто-желтый цвет, цинка — пурпурно-красный, свинца — карминно-красный, таллия — красно-фиолетовый.
3. Образование дитизонатов металлов идет при строго определенном значении рН среды. Дитизонаты серебра и ртути образуются при рН 1, цинка рН 4-4,5 (химизм реакции идет по кетоформе дитизона). Для отличия дитизона серебра и ртути полученный комплекс встряхивают с раствором хлористоводородной кислоты, дитизонат серебра разлагается, хлороформный слой окрашивается в зеленый цвет. Дитизонат ртути в этих условиях устойчив. Дитизонат свинца образуется при рН 7-10, таллия — при рН 11-12 (химизм реакции идет по енольной форме дитизона).
3.5. МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ
При отравлении «металлическими ядами» содержание их в различных органах будет колебаться в зависимости от принятого количества, времени, наступления смерти и оказания помощи. Поэтому для каждого элемента рекомендованы два метода количественного анализа (фотоэлектроколориметрическим и объемный) или один метод определения в широком интервале концентраций.
Классификация и характеристика методов количественного определения
1. Весовой метод (применяется при анализе на барий) обладает самой низкой чувствительностью, границы определения Ва в виде BaSО4 составляет 5 мг.
2. Объемные (титриметрические) методы. Из объемных методов чаще всего применяется комплексонометрия: прямое титрование после экстракции с последующей реэкстракцией при анализе экстракционных катионов (медь, висмут, кадмий, цинк), обратное титрование — для осадочных катионов (барий, свинец). Граница определения — 0,5-1,0 мг. При анализе на катион серебра применяют роданометрический метод, на катион свинца — хромато-иодометрический метод, граница определения этих методов составляет 2,0 мг. Окислительно-восстановительная реакция с получением окрашенных растворов при изменении степени окисления марганца от 2 до 7 лежит в основе колориметрического титрования, границы определения 0,02 мг.
3. Фотометрические методы основаны на измерении оптической плотности окрашенных комплексов металлов с органическими реагентами, граница определения металлов в виде дитизонатов составляет 0,02 мг, в виде ДДТК — 0,1 мг.
3.6. ДРОБНОЕ ОБНАРУЖЕНИЕ, ОПРЕДЕЛЕНИЕ И ТОКСИКОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ОТДЕЛЬНЫХ КАТИОНОВ
Токсикологическое значение свинца
Токсикологическое значение свинца определяется ядовитыми свойствами металлического свинца, его солей и некоторых производных: широким и разнообразным применением их в промышленности и быту.
Из различных соединений свинца наибольшее токсикологическое значение имеют арсенат, ацетат, хромат, карбонат, хлорид, нитрат и ряд других солей этого металла. Оксид свинца применяется для приготовления некоторых красок, входит в состав свинцового пластыря. Свинца карбонат является одним из компонентов свинцовых белил. В состав некоторых красок входит и свинца хромат. Свинца арсенат относится к числу соединений, применяемых для борьбы с вредителями садов и виноградников. Основной свинца ацетат в ряде стран применяется и медицине. Стеарат, олеат и другие соединения свинца с органическими кислотами используются в качестве стабилизаторов при получении пластмасс. Эти соединения используются как добавки к краскам, а также входят в состав некоторых помад и жидкостей для волос.
Особенно опасными в отношении отравлений свинцом являются добыча свинцовых руд, выплавка свинца, производство аккумуляторов, свинцовых красок [свинцовые белила 2РbСО3.Рb(ОН)2 и сурик Рb3О4], применение которых в России ограничивается только окраской судов и мостов, лужение, пайка, применение свинцовой глазури PbSiО3 и т. д. При недостаточной охране труда возможны промышленные отравления.
Источниками бытовых отравлений являлось в ряде случаев недоброкачественно луженая (при употреблении консервов, изготовленных в недоброкачественно луженной посуде), эмалированная, фарфорово-фаянсовая и глиняная посуда, покрытая глазурью. Описаны случаи отравления свинцом через питьевую воду (свинцовые трубы), нюхательный табак, завернутый в свинцовую бумагу, после огнестрельного ранения и т.п. Более известны также случаи отравлений свинцовыми солями и тетраэтилсвинцом.
Основным источником отравлений соединениями свинца является поступление их в пищевой канал.
Ионы свинца, поступившие в организм, соединяются с сульфгидрильными и другими функциональными группами ферментов и некоторых других жизненно важных белковых соединений. Около 90 % ионов свинца, поступивших в кровь, связываются эритроцитами (по Р. Лудевигу и К. Лосу, 1983).
Свинец является протоплазматическим ядом, вызывающим изменения главным образом в нервной ткани, крови и сосудах. Ядовитость соединений свинца в значительной степени связана с растворимостью их и в желудочном соке, и в других жидкостях организма. Хроническое отравление свинцом дает характерную клиническую картину. Смертельная доза различных соединений свинца неодинакова. Дети особенно чувствительны к нему.
Свинец поражает все отделы головного мозга, особенно гипоталамические отделы и ретикулярную формацию ствола. Свинец блокирует ферменты, участвующие в синтезе гема. Развивается гипохромная анемия при нормальном содержании железа сыворотки. Кроме того, свинец повышает гемолиз эритроцитов.
Свинец не относится к числу биологических элементов, но обычно присутствует в воде и пище, откуда поступает в организм. Человек, не занятый работой со свинцом, поглощает в сутки, как указывает Н. В. Лазарев, 0,05 — 2 г свинца (в среднем 0,3 мг). Соединения свинца способны кумулироваться в костной ткани, печени, почках. Около 10% его всасывается организмом, остальное количество выделяется с калом. Свинец откладывается в печени и в трубчатых, несколько меньше в плоских костях. В остальных органах откладывается в незначительном количестве. Отсюда необходимость обнаружения свинца во внутренних органах трупов людей, умерших от других причин, и обязательное количественное определения его при положительных результатах качественного анализа.
Естественное содержание свинца (по данным А. О. Войнара, в миллиграммах на 100 г органа) в печени 0,130; в почке 0,027; в трубчатых костях 1,88; в желудке и кишечнике 0,022 и 0,023 соответственно.
Соединения свинца выделяются из организма главным образом с калом. Меньшие количества этих соединений выделяются с желчью, а следовые количества — с мочой. Соединения свинца частично откладываются в костной ткани в виде трехзамещенного фосфата.
Патологоанатомическая картина в острых случаях общая для соединений тяжелых металлов.
Клиническая картина. Острое отравление — головная боль, слабость, головокружение, рвота, брадикардия, артериальная гипотензия, потливость, слюнотечение, зуд, парестезии, тремор конечностей. Симптомы часто развиваются через 6 ч — 2 сут после отравления. При вдыхании паров более выражена неврологическая симптоматика: бессонница, головная боль, атаксия, судороги, галлюцинации, психомоторное возбуждение. При пероральном приеме — диспептические расстройства: жажда, отрыжка, боль в животе, тошнота, рвота, диарея. У детей в течение 1-5 дней — стойкая неукротимая рвота, атаксия, судороги, нарушения сознания.
Хроническое отравление, Возможно возникновение тремора конечностей, повышенной утомляемости, раздражительности, расстройств памяти, бессонницы. Дискомфорт в области живота, рвота, снижение массы тела, гипотрофия мышц. Возможно развитие почечной недостаточности.
Тяжелая интоксикация (острая или хроническая): алиментарный синдром — анорексия, привкус металла (при хронической интоксикации — ощущение волоса) во рту, запоры, кишечные колики, напряжение мышц брюшной стенки (иногда), на дёснах — свинцовая (сине-черная) кайма. Нервно-мышечный синдром (чаще у взрослых): безболезненный периферический неврит и слабость мышц-разгибателей. При хроническом отравлении — свинцовая энцефалопатия (чаще у детей) с эпилептиформными припадками, коматозное состояние; долговременные остаточные явления, включающие неврологические дефекты (нейроциркуляторная триада — артериальная гипотензия, брадикардия, гипотермия), психопатологические расстройства (упорные головные боли, бессонница, повышенная возбудимость, беспокойный сон с кошмарами), задержка умственного развития (у детей). При остром отравлении — галлюцинации, бред, психомоторное возбуждение, маниакальный синдром, судороги.
Беременность. Отравление свинцом во время беременности приводит к рождению недоношенных детей и преждевременному родоразрешению. Свинец обладает тератогенными свойствами.
При решении вопроса об отравлении тетраэтилсвинцом (С2Н5)4Рb применяют специальную методику, основанную на изолировании этого яда перегонкой с водяным паром.
Выше было обосновано, что при разбавлении минерализата водой возможно появление мути или выпадение осадка. Это означает, что в минерализате находится белый осадок свинца сульфата. Такого же цвета осадок бария сульфата образуется при отравлении соединениями бария. В результате соосаждения осадки сульфатов свинца и бария могут быть загрязнены ионами кальция, хрома, железа и др. При наличии хрома в осадке он имеет грязно-зеленую окраску. Химико–токсикологический интерес представляют только барий и свинец, которые необходимо до обнаружения разделить.
Оптимальными условиями для количественного осаждения Ва2+ и Рb2+ являются: концентрация в минерализате
20 % H2SO4, отсутствие окислов азота (частичное растворение PbSО4 и в значительно меньшей степени BaSО4 в кислоте азотной), время осаждения (
24 часа). Вследствие соосаждения в осадке могут также находиться Са2+, Fe3+, Al3+, Cr3+, Zn2+, Cu2+ и др. При соосаждении Сr3+ осадок окрашен в грязно-зеленый цвет. Во избежание потерь Сr3+ грязно-зеленый осадок обрабатывают при нагревании раствором персульфата аммония в 1% растворе серной кислоты. Нерастворившийся осадок подвергают анализу на Ва2+ и Рb2+, а фильтрат оставляют для количественного определения хрома.
Исследование фильтрата на свинец
а) реакцией с дитизоном (H2Dz)
К раствору, содержащему свинца ацетат, прибавляют хлороформный раствор дитизона и взбалтывают. При этом образуется однозамещенный дитизонат свинца Pb(HDz)2, хлороформный раствор которого имеет оранжево-красную окраску:
В зависимости от объема водного слоя раствор исследуют далее микрокристаллическими или макрохимическими реакциями.
При малом объеме водного слоя
а) получают двойную соль йодида цезия и свинца — Cs[PbI3]
(CH3COO)2Pb + CsCl + 3 KI ® Cs[PbI3] ¯ + KCl + 2 CH3COOK
При наличии ионов свинца образуются прозрачные игольчатые кристаллы на жёлтом фоне.
б) образование гексанитрита калия, меди и свинца K2Cu[Pb(NO2)6]
(CH3COO)2Pb + (CH3COO)2Cu + 6 KNO2 ® K2Cu[Pb(NO2)6] ¯ + 4 CH3COOK
Образование чёрных или коричневых кристаллов, имеющих форму куба, указывает на наличие ионов свинца.
При большом объеме водного слоя (2 мл и более)
а) образования PbS:
(CH3COO)2Pb + Na2S = PbS¯ + 2 CH3COO Na
При наличии ионов свинца появляется чёрный осадок.
Осадок не растворяется в разбавленных серной и соляной кислотах, но растворяется в разбавленной кислоте азотной с выделением окислов азота и элементарной серы:
3PbS + 8HNО3 = 3Pb(NО3)2 + 2NO + 3S + 4H2О;
б) образование PbSО4:
(CH3COO)2Pb + H2SO4 ® PbSO4 ¯ + 2 CH3COOH
При наличии ионов свинца появляется белый осадок
Осадок свинца сульфата растворяется в концентрированной серной кислоте с образованием кислой соли:
PbSО4 + H2SО4 = Pb(hso4)2
При добавлении воды вновь выпадает осадок сульфата свинца.
в) образования РbСrО4: нерастворим в уксусной кислоте, но растворим в минеральных кислотах и едких щелочах:
2 (CH3COO)2Pb + K2Cr2O7 + H2O ® 2 PbCrO4 ¯ + 2 CH3COOK + 2 CH3COOH
При наличии ионов свинца появляется оранжево–жёлтый осадок.
г) образования PbI2:
(CH3COO)2Pb + 2 KI ® PbI2 ¯ + 2 CH3COOK
При наличии ионов свинца выпадает жёлтый осадок, который растворяется при нагревании и вновь появляется при охлаждении (в избытке реактива осадок растворяется).
Из соединений бария токсикологическое значение имеют его гидроксид, хлорид, нитрат, карбонат, хлорат и др. Все растворимые соли бария ядовиты. Соединения бария применяю для получения препаратов бария, в керамическом и стекольном производстве (ВаСОз), в текстильной и резиновой промышленности, в сельском хозяйстве (ВаС12) для борьбы с вредителями растений; селенит бария (BaSeО3) и бария карбонат применяют для дератизации. Некоторые препараты бария, например бария хлорид, гидрат окиси бария, имеют применение в аналитических лабораториях. Бария сульфат, применяемый при рентгеноскопии, практически нетоксичен. Смерть наступает от паралича сердца.
В истории отравлений барием различают два периода: первый — до введения бария сульфата в качестве контрастного вещества при рентгенологическом исследовании желудочно-кишечного тракта, второй — после введения бария сульфата в рентгеноскопию. В первом периоде отравления соединениями бария были редкими. Причиной их было применение бария карбоната в смеси с мукой для отравления крыс или бария хлорида для аппретуры белья. С момента внедрения бария сульфата в медицинскую практику отравления солями бария стали встречаться чаще. Причиной этих интоксикаций, как правило, является бария сульфат, нерастворимый в воде и в жидкостях организма, а растворимые соли его, содержащиеся в бария сульфате в виде примесей, или ошибочное применение растворимых солей бария вместо бария сульфата. Известны случаи отравления бария карбонатом, находящимся в бария сульфате в виде примесей. Такие отравления объясняются тем, что для рентгеноскопии используют большие (до 100 г и более) количества бария сульфата, который по способу своего получения может содержать бария карбонат, переходящий в организме под влиянием соляной кислоты желудочного сока в растворимый бария хлорид.
При приеме внутрь ядовитых соединений бария возникают жжение во рту, боли в области желудка, слюнотечение, тошнота, рвота, головокружение, мышечная слабость, одышка, замедление пульса и падение артериального давления. Основной метод лечения отравлений барием — промывание желудка и употребление слабительных средств. Основными источниками поступления бария в организм человека являются пища (особенно морепродукты) и питьевая вода. По рекомендации Всемирной организацией здравоохранения содержание бария в питьевой воде не должно превышать 0,7 мг/л, в России действуют гораздо более жесткие нормы — 0,1 мг/л.
Соединения бария оказываются нейротоксическое (паралитическое), кардиотоксическое, гемотоксическое действия. Основные симптомы: жжение во рту и пищеводе, боли в животе, тошнота, рвота, диарея, головокружение; кожные покровы бледные, покрыты холодным потом. Пульс медленный, слабый; экстрасистолия, мерцание предсердий, возможна остановка сердца; снижение АД; одышка, цианоз. Через 2-3 ч после отравления — нарастающая мышечная слабость (особенно мышц верхних конечностей и шеи), иногда гемолиз.
Соединения бария выделяются из организма главным образом через кишечник. Следовые количества этих соединений выводятся через почки и частично откладываются в костях. Сведения о содержании бария как нормальной составной части клеток и тканей организма в литературе отсутствует.
Патологоанатомическая картина неспецифична: наблюдаются гиперемия и кровоизлияния в слизистой оболочке желудка, кишках, серозных покровах и в легких, жировое перерождение печени. Химико-токсикологическое исследование оказывает серьезную помощь в диагностике отравлений. Выделение бария происходит главным образом через желудочно-кишечный тракт. Ва2+ в незначительных количествах содержится во всех органах и тканях живых существ в качестве естественной составной части организма (А. О. Войнар).
Исследование фильтрата на барий
1. Реакция перекристаллизации BaSО4 из концентрированной кислоты серной.
Часть исследуемого осадка на фильтре переносят на предметное стекло и слегка подсушивают. Затем к осадку прибавляют 2 капли концентрированной кислоты серной и осторожно нагревают до появления паров. (Кислота серная не должна растекаться на предметном стекле). При наличии в осадке бария сульфата на стекле через 15 – 20 мин после охлаждения появляются бесцветные кристаллы, имеющие форму квадратов с вытянутыми углами или в виде мелких крестов и прямоугольных пластинок.
2. Реакция образования бария йодата
BaSO4 
BaS + 2 HCl ® BaCl2 + H2S
BaCl2 + 2 KIO3 ® Ba(IO3)2 + 2 KCl
На предметное стекло наносят несколько капель 10 % раствора кислоты хлороводородной. Затем платиновой петлёй забирают часть исследуемого осадка и нагревают его в восстановительной части пламени горелки. При этом бария сульфат восстанавливается в бария сульфид, а пламя горелки окрашивается в зелёный цвет.
При исследовании больших количеств осадка и при поступлении на химико–токсикологический анализ химических соединений бария возможно проведение дополнительных подтверждающих реакций.
3. Реакция с калия бихроматом
2 BaCl2 + K2Cr2O7 + H2O
Выпадает жёлтый кристаллический осадок.
4. Реакция с кислотой серной
BaCl2 + H2SO4 ® BaSO4 ¯ + 2 HCl
Выпадает белый кристаллический осадок.
5. Реакция с натрия родизонатом
В присутствии катиона бария на бумаге появляется красновато–коричневое пятно не исчезающее от добавления капли кислоты хлороводородной (отличие от стронция).
Объектами исследования на наличие бария могут быть не только органы трупов и биологические жидкости, но и химические соединения этого металла, которые в народном хозяйстве широко используются для борьбы с вредителями сельскохозяйственных культур и для других целей.
Исследование минерализата после отделения осадка
Исследование обычно начинают с Mn2+ и Cr 3+, так как определенное мешающее влияние оказывают Cl-. В основу обнаружения и определения этих катионов положены реакции окисления – восстановления.
Токсикологическое значение марганца. В последние годы соединения марганца приобретают все большее значение в различных областях промышленности: металлургической, стекольной при изготовлении глазури и эмали, химической, ситцепечатании и др. Применяют также некоторые соединения марганца (КМnО4) в медицине и в санитарии.
Соединения марганца являются сильными протоплазматическими ядами, особенно действуют на центральную нервную систему, вызывая в ней тяжелые органические изменения, поражает также почки, органы кровообращения, легкие.
Марганец получил известность главным образом как профессиональный яд. При действии на организм через органы дыхания соединения марганца приводят к тяжелым поражениям центральной нервной системы, а также действуют на почки, органы кровообращения и легкие. Предельно допустимой концентрацией марганца и его соединений в воздухе является 0,0003 мг/л в пересчете на марганец (Н. В. Лазарев).
Острые отравления соединениями марганца нередко приводят к смерти. Причиной смерти были отравления и калия перманганатом, примененным при криминальном аборте.
Смертельная доза калия перманганата для человека точно неустановленна.
По данным А. О. Войнара, при приеме внутрь она составляет 15—20 г.
При вскрытии трупов лиц, погибших в результате отравления калия перманганатом, характерными считаются ожог слизистой оболочки, напоминающий отравление едкими веществами, дегенеративные изменения паренхиматозных органов, главным образом сердца, печени, почек (О. И. Глазова).
При полосканиях, спринцеваниях концентрированными растворами калия перманганата наблюдается отек слизистых оболочек с последующими воспалительными явлениями, приводящими иногда к общему отравлению организма. Независимо oт способа введения марганец выводится из организма через желудочно-кишечный тракт и с мочой. Основным органом, задерживающим марганец, является печень.
Марганец относится к числу широко распространенных элементов, играющих в организме животных определенную биологическую роль. Этим обстоятельством объясняется обязательное обнаружение марганца при судебно-химическом анализе внутренних органов трупа человека. Этим же диктуется необходимость количественного определения при положительных результатах качественного обнаружения его в биологическом материале.
Общее содержание Mn+2 в организме человека доходит до 0,05%; и в экскриментах его содержится 1,8 мг и в печени 0,17- 0,2 мг на 100 г свежего материала.
А.Н. Крылова дробным методом определяла в 100 г печени 0,13 – 0,40 мг естественно содержащегося Mn2+ , в почке и матке 0,06 – 0,28 и 0,04 — 0,16мг.
Обнаружение марганца основано на реакциях окисления Mn2+ до Mn7+ (перманганат–иона), который окрашивает реакционный раствор в цвета от розового до красно–фиолетового в зависимости от концентрации в минерали-зате.
1. Окисление калия перйоодатом
2 MnSO4 + 5 KIO4 + 3 H2O ® 2 HMnO4 + 5 KIO3 + 2 H2SO4
В присутствии марганца появляется окраска от розового до красно -фиолетового цвета.
2. Окислениеи натрия висмутатом
2 Mn(NO3)2 + 5 NaBiO3 + 16 HNO3 ®
® 2 HMnO4 + 5 Bi(NO3)3 + 5 NaNO3 + 7 H2O
В присутствии марганца появляется розовое окрашивание.
3. Окисление аммония персульфатом
2 MnSO4 + 5 (NH4)S2O8 + 8 H2O ® 2 HMnO4 + 5 (NH4)2SO4 + 7 H2SO4
В присутствии марганца появляется розовое окрашивание.
Токсикологическое значение хрома. Соли хрома широко применяются в различных областях народного хозяйства. Некоторые соединения хрома используются в сельском хозяйстве. В медицине соединения хрома из-за их высокой токсичности в настоящее время не используются.
Наиболее ядовиты хроматы и бихроматы, последние токсичнее хроматов. Соли шестивалентного хрома обладают способностью, действовать раздражающе и прижигающе на кожу и слизистые оболочки, вызывая изъязвления. Типичным признаком является прободение хрящевой части носовой перегородки. В последнее время установлено, что хром обладает канцерогенным действием.
При приемах внутрь наблюдаются ожоги слизистой оболочки рта, пищевода, желудка, припухание, отечность, окрашивание в желтый цвет слизистой полости рта, рвота, иногда кровавая, желтыми или зелеными массами. В литературе имеются разноречивые данные о смертельной дозе солей кислоты хромовой: 0,2 — 0,5 -1 г и даже 8 г (Гадамер). При вскрытии трупов отмечаются явления отравления едкими веществами и желтое окрашивание слизистых оболочек. При острых отравлениях хром накапливается в печени, почках, эндокринных железах.
Хром относится к числу элементов, постоянно обнаруживаемых в организме животных и человека. Описанной выше методикой хром, естественно содержащийся в органах трупа человека, при химико-токсикологическом анализе не обнаруживается.
При обнаружении хрома, который при минерализации объекта смесью серной и азотной кислот находится в минерализате в основном в степени окисления 3+, его окисляют аммония персульфатом до степени окисления 6+.
В качестве основной реакции используется реакция взаимодействия Cr6+ с дифенилкарбазидом.
1. Реакция с дифенилкарбазидом
Cr2(SO4)3 + 3 (NH4)2S2O8 + 7 H2O
При наличии хрома жидкость в пробирке приобретает красно–фиолетовое окрашивание.
2. Реакция образования надхромовых кислот
В присутствии хрома растворитель окрашивается в сине–голубой цвет.
Токсикологическое значение имеет лишь серебра нитрат. Он оказывает прижигающее и вяжущее действие на кожу и слизистые оболочки. При длительной работе, как с металлическим серебром, так и с его солями может возникать аргирия (отложение металлического серебра в тканях), проявляющаяся в серо-зеленой до аспидно-серой окраске кожи и слизистых оболочек.
Отравления соединениями серебра большей частью являются случайными, но известны также случаи покушения на самоубийство с помощью серебра нитрата. Проф. А. В. Степанов в руководстве по судебной химии указывает, что предметом судебно-химического исследования неоднократно являлись краски для волос, содержавшие серебро. Соединения серебра при этом способны отчасти восстанавливаться в металлическое серебро, а также, частично разлагая содержащие серу вещества волос, переходить в черный серебра сульфид и обусловливать окраску волос. В качестве окрашивающих растворов применялись раствор серебра нитрата или аммиачный раствор серебра хлорида. Второй жидкостью, ускоряющей окраску, обычно являлся раствор натрия сульфида или аммония.
Серебро довольно широко распространено как в низших, так и в высших животных организмах. По А. О. Войнару, в органах человека обнаруживают в пересчете на 100 г свежих тканей в крови — следы, в мозгу — 0,03 мг, в печени — 0,005 мг, в легких — 0,004 мг, в костях — 0,01 мг серебра.
Естественно содержащееся в органах человека серебро не обнаруживается дробным методом анализа.
1. Основной реакцией при обнаружении серебра является реакция образования серебра дитизоната.
Для отличия серебра дитизоната от ртути дитизоната окрашенный хлороформный слой обрабатывают при энергичном встряхивании 1 мл 0,5моль/л раствором кислоты хлороводородной. Серебра дитизонат в этих условиях разрушается и золотисто — жёлтая окраска хлороформного слоя переходит в зелёную.
При положительном результате реакции с дитизоном серебро из минерализата выделяют в виде серебра хлорида.
2. Рекция образования серебра хлорида
Ag2SO4 + 2 NaCl ® 2 AgCl ¯ + Na2SO4
При наличии иона сереба образуется белый осадок или муть. Жидкость нагревают до кипения и осадок отделяют фильтрованием после охлаждения,
промывают его один раз водой очищенной и растворяют в 0,5 – 2,5 мл 25 % раствора аммиака.
AgCl + 2 (NH4)OH ® [Ag(NH3)2]Cl + 2 H2O
Аммиачный раствор исследуют следующим образом:
а) Каплю раствора помещают на предметное стекло, дают капле медленно (без нагревания) испариться. При наличии серебра выделяются мелкие прозрачные кристаллы в виде кубов, октаэдров, четырёхугольников. (Смотреть под микроскопом при большом увеличении).
б) К капле исследуемого раствора на предметном стекле прибавляют каплю кислоты азотной разведённой – выпадает белый творожистый осадок серебра хлорида.
[Ag(NH3)2]Cl + 2 HNO3 ® AgCl ¯ + 2 NH4NO3
в) 1 – 2 капли исследуемого раствора упаривают на предмет-ном стекле. На остаток наносят по 1 капле насыщенных растворов тиомочевины и калия пикрата. Образуются жёлтые призматические кристаллы в виде розеток пикрата тиомочевинного комплекса серебра: [AgSC(NH2)2] [C6H2(NO2)3OH].
г) 1 – 2 капли исследуемого раствора помещают на фильтровальную бумагу, на которую ранее была нанесена капля раствора FeSO4. При наличии серебра в центре пятна возникает чёрная окраска Ag (металлическое серебро), а по краям красно–оранжевое кольцо Fe3+.
[Ag(NH3)2]Cl + FeSO4 + H2O ® Ag + Fe(OH)SO4 + NH4Cl + NH3 .
Токсикологическое значение. Различные соединения цинка широко применяются в промышленности, сельском хозяйстве, быту, медицине. Токсикологическое значение имеют главным образом растворимые соли цинка, например цинка хлорид, применяемый в качестве консерванта древесины и входящий в состав так называемой паяльной жидкости, а также цинка фосфид.
Цинка сульфат используется в промышленности в качестве протравы при крашении тканей и в медицине в качестве прижигающего и дезинфицирующего средства. Цинка фосфид применяется в борьбе с грызунами и неоднократно был причиной отравления домашних птиц; отмечены случаи умышленного отравления этим препаратом людей. Известны также случаи «пищевых» отравлений солями цинка вследствие приготовления или хранения пищи, особенно кислой, в оцинкованной посуде.
Смертельных отравлений соединениями цинка (цинка фосфид является исключением) в литературе не описано. Благодаря быстро наступающей рвоте при приемах внутрь солей цинка смертельная, доза сравнительно велика. По Коберту она составляет для цинка хлорида около 5 г.
При остром отравлении солями цинка наблюдаются тошнота, упорная рвота, понос, судороги. Слизистые оболочки полости рта сморщены, белые. При хронических отравлениях среди рабочих, занятых выплавкой латуни, бронзы, разработкой цинковых руд, наблюдается вызываемая вдыханием цинка «цинковая», «латунная» или «литейная» лихорадка, выражающаяся в ряде признаков заболевания и в том числе в приступах озноба и повышении температуры до 37 — 40°.
Цинк, введенный в организм, накапливается в печени и поджелудочной железе. Соли цинка выводятся главным образом через желудочно-кишечный тракт, в меньшей степени — с мочой.
Цинк поступает в организм с пищей. Является широко распространенным элементом как в неживой природе, так и в растительных и животных организмах. В органах человека, по данным А. О. Войнара, наибольшие количества цинка содержатся (в пересчете на 100 г свежего материала) в печени (5,4 -14,5 мг), почках (5,5 мг), волосах (16,3 мг) и костях 10,09 мг.
Дробным методом обнаруживается 2,73 — 6,71 мг естественно содержащегося Zn2+ в 100 г почек и 1,76 — 6,16 мг в 100 г печени, что необходимо учитывать при судебно-медицинской оценке результатов химико-токсикологического анализа.
При обнаружении цинка вначале проводят реакцию образования цинка дитизоната (основная реакция).
Хлороформный слой окрашивается в розово–фиолетовый цвет.
При положительном результате это реакции на цинк проводят подтверждающие реакции после выделения цинка из минерализата в виде диэтилдитиокарбамината с последующей реэкстракцией 1 моль/л раствором хлороводородной кислоты.
Водное извлечение отделяют, делят на три части и проделывают следующие реакции:
а) Реакция с калия гексацианоферратом (II)
ZnCl2 + K4[Fe(CN)6] 
Появляется муть или белый осадок.
б) Реакция образования цинка сульфида
ZnCl2 + H2S 
Образуются осадок или муть белого цвета.
в) Реакция с аммония тетрароданомеркуратом
ZnCl2 + (NH4)2 [Hg(SCN)4] ® Zn[Hg(SCN)4] ¯ + 2 NH4Cl
Появляются кристаллы в виде дендритов или одиночных клинообразных кристаллов.
Токсикологическое значение. Медь и ее соли широко применяются в промышленности. Для получения красок и в ситцепечатании используются CuO, CuCl2, Cu(NО3)2, СuСО3.Сu(ОН)2 (малахит), Cu(OCOCH3)2, Cu(OCOCH3)2.Cu(OH)2.H2О (ацетат меди основной — ярь-медянка). Сульфат меди CuSО4 применяется, кроме того, в гальванопластике, для пропитки дерева, в производстве чернил; ряд соединений меди используется в сельском хозяйстве в качестве инсектофунгицидов, например CuO, CuCl2, Cu2(OCl)2, CuSО4, CuCО3.Cu(OH)2 (последнее соединение известно под названием препарата АБ). В медицине применяются сульфат меди CuSО4. 5H2О и цитрат меди Си2С6Н4О7. 2,5Н2О.
Токсикологическое значение соединений меди невелико. Смертельной дозой сульфата меди считают 10 г.
Отравления медью в большинстве случаев являются комбинированными (медью и свинцом, медью и цинком и т. п.). При химико-токсикологических исследованиях имеет значение одновременное нахождение в объекте исследования Сu2+ и As2О5 что указывает на возможность отравления швейнфуртской (парижской) зеленью — Cu(OCOCH3)2-3Cu(AsО2)2, зеленью Шееле — Cu2AS2О5 и другими препаратами меди и мышьяка, применявшимися в сельском хозяйстве в качестве инсектофунгицидов. Объектами химико-токсикологического исследования могут оказаться рвотные массы и различные пищевые продукты, в которые медь попадает в результате приготовления пищи в плохо луженой посуде, варки в медном тазу с последующим оставлением в нем охлажденного варенья и т. п.
Широкое распространение меди в природе ведет к нахождению меди во многих растениях, например в семенах бобовых растений; медь находится и в печени, а также во внутренних органах трупов людей, особенно пожилых.
Все это указывает на особую необходимость в случае нахождения меди производить количественное определение, чтобы дать возможность судебно-медицинским экспертам и суду решить, является ли найденная медь естественной составной частью данного объекта, например зеленого горошка, внутренних органов трупа и т. д., или введена умышленно (для окраски консервов или других целей).
А. Н. Крылова определяла дробным методом медь в 100 г печени в пределах 0,56 — 1,12 мг; в почках 0,25 — 0,40 мг и в головном мозге 0,31 — 0,34 мг. Эти количества меди при судебно-медицинской оценки результатов химико – токсикологического анализа должны рассматриваться как естественно содержащиеся количества.
Обнаружение меди основано на избирательной экстракции её из мине-рализата в виде диэтилдитиокарбамината меди с последующей реэкстракцией 1 % раствором сулемы.
Водный слой отделяют от хлороформа, делят на три части и проделывают следующие подтверждающие реакции:
а) Реакция образования меди цинкатетрародано — меркурата
CuCl2 + 2 (NH4)2[Hg(CNS)4] + ZnSO4 ®
® Cu Zn [Hg(CNS)4]2 ¯ + 2 (NH4)Cl + (NH4)2SO4
В присутствии меди выпавший осадок окрашивается в лилово–розовый цвет.
б) Реакция образования меди — кадмия гексацианоферрата
CuCl2 + CdCl2 + K4[Fe(CN)6] ® Cu Cd [Fe(CN)6] ¯ + 4 KCl
В присутствии меди выпавший осадок окрашивается в сиреневый цвет.
в) Реакция образования пиридинроданидного комплекса меди
В присутствии меди хлороформ окрашивается в изумрудно–зелёный цвет.
Токсикологическое значение. Металлический висмут применяется в промышленности для получения сплавов с низкой температурой плавления. Соли висмута применяются в фотографии для изготовления косметических мазей и медицинских препаратов [BiOCI, Bi(NО3)s.5H2O, Bi(NО3)3-Bi(OH)3], светящихся со ставов [Bi(NО3)3-5H2О], в производстве хрустального стекла Bi2О3. Медицинскими препаратами висмута являются нитрат основной висмута и органические соединения висмута.
Ядовитыми свойствами обладают легко растворимые соединения висмута, применяемые в терапевтической практике в качестве противосифилитических или рвотных средств. Однако и трудно растворимые соли висмута под влиянием соляной, молочной и других органических кислот образуют легко растворимые комплексные соединения висмута, всасывающиеся в кишечнике. При введении в кровь комплексных солей наблюдались отравления висмутом. Всосавшийся висмут долго задерживается в организме, преимущественно в печени, почках, селезенке, легких, в ткани мозга, и может быть обнаружен в них по прошествии длительных сроков после его введения. Выделение висмута происходит через почки, слизистые оболочки желудочно-кишечного тракта и через потовые железы. Выделяясь потовыми железами, препараты висмута могут вызывать кожный зуд и быть причиной дерматитов.
В следах (цифровые данные в литературе отсутствуют) висмут обнаружен в органах людей как естественно содержащийся элемент.
Дробным методом естественно содержащийся висмут в печени трупа человека не определяется.
1. Реакция с 8–оксихинолином (основная реакция)
Bi3+ + 4 KI ® [BiI4]– + 4 K+
При добавлении к образовавшемуся осадку 1 мл смеси ацетона и этилацетата (1 : 1) и последующем встряхивании осадок растворяется в органическом растворителе, окрашивая последний в цвета от жёлтого до малинового.
- Реакция с тиомочевинной
При наличии ионов висмута появляется лимонно–жёлтое окрашивание
В случае положительного результата этих двух реакций висмут экстрагируют из минерализата в виде ДДТК–висмута.
Хлороформное извлечение отделяют, промывают водой и встряхивают с 1 мл концентрированной кислоты азотной. Азотнокислый реэкстракт отделяют и делят на 2 части, производят реакции:
а) Реакция с цезия хлоридом и калия йодидом (микрокристаллическая) Образуются оранжевые кристаллы в виде многоугольников и шестилучевых звёздCs [BiI4].
б) Реакция с калия бромидом и бруцином (микрокристаллическая)
Образуются зеленоватые игольчатые кристаллы в виде сфероидов.
Токсикологическое значение. Кадмий широко применяется в различных отраслях промышленности: для получения легкоплавких сплавов, изготовления электродов щелочных аккумуляторов, кадмирования, производства кадмиевых ламп, в фотографии, ювелирном деле. Кадмием заменяют олово для посуды или висмут в типографском шрифте и др.
Металлический кадмий при плавке и окись кадмия ядовиты. Кадмированная посуда может быть источником отравлений вследствие растворимости кадмия в кислых пищевых продуктах. Описаны случаи отравлений как производственного, так и бытового характера.
Соли кадмия, попавшие в желудочно-кишечный тракт, вызывают воспаление почек, жировое перерождение печени и сердца, кишечные кровотечения. Накапливается Cd2+ главным образом в печени и почках.
Смертельная доза солей кадмия, принятых через рот, для человека не установлена.
Предельно допустимая концентрация кадмия в воздухе составляет 0,0001 — 0,001 мг/м3. Количества аэрозоля окиси кадмия, равные 2500 — 2900 мг/м3, являются смертельными.
Из организма кадмий выводится очень медленно. Он постоянно встречается в растительных и животных организмах и является микроэлементом. В органах человека кадмий является естественно содержащимся элементом и постоянно обнаруживается и определяется при химико-токсикологическом анализе внутренних органов трупа человека. Т. М. Моисеева определяла естественно содержащийся кадмий в почках (0,31- 2,92 мг) и печени (0,21 — 0,42 мг) трупа человека даже при систематическом сероводородном методе анализа. Дробным методом определяется 0,64- 6,68 мг Cd2+ в 100 г печени и 1,32 — 8,48 мг Cd2+ в 100 г почек человека. Эти количества Cd2+ необходимо учитывать при судебно-медицинской оценке результатов химико-токсикологического анализа как естественно содержащиеся.
Наличие кадмия подтверждают после выделения его из минерализата в виде кадмия диэтилдитиокарбамината с последующей реэкстракцией его 1 моль/л кислотой хлороводородной.
Реэкстракт используют для проведения следующих реакций.
1. Реакция образования кадмия сульфида
CdCl2 + Na2S 
Образуется муть или осадок канареечно–жёлтого цвета.
2. Реакция образования кадмия ферроцианида
2 CdCl2 + K4[Fe(CN)6] 
Появляется муть или осадок белого цвета.
При положительном результате этих реакций проводят микрокристаллические реакции:
а) Реакция с бруцином и натрия бромидом
В присутствии кадмия образуются бесцвет-ные призматические кристаллы в виде сфероидов:[C23H26N2O4H]2 [CdBr4].
б) Реакция с пиридином и калия бромидом
Появляются бесцветные призматические кристаллы в виде сфероидов:[C5H5N H]2 [CdBr4].
Токсикологическое значение ртути
Металлическая ртуть, а также ее соли имеют широкое и разнообразное применение в производстве люминесцентных, кварцевых и радиоламп, при изготовлении контрольно-измерительных приборов, ртутных выпрямителей, ртутных насосов. Широко используется при электролитическом способе получения хлора, калибровании химической посуды, извлечении золота и серебра из руд и для многих других солей. Из солей ртути особенно широкое применение имеет сулема, несколько меньшее – ртути нитрат, ртути сульфид, сулема, ртуть йодная и др. Широкое применение ртути и ее производных в промышленности и сельском хозяйстве делает возможным соприкосновение с ними довольно большого круга людей. Поэтому могут создаваться условия для отравления (профессиональные, медицинские, бытовые в связи с ошибочными приемами соединений ртути внутрь, при вдыхании паров ртути или ее препаратов, при передозировках и т. п.).
Характер и течение ртутных отравлений различны и зависят от способа введения ртути в организм. Пары ртути, попадая в организм через органы дыхания, поражают прежде всего, центральную нервную систему, в первую очередь кору головного мозга. Специфическое действие ртути обусловлено связыванием белковых сульфгидрильных групп, что приводит к нарушению клеточного дыхания и преципитации белков. В случаях отравления солями ртути, принятыми per os, в основном поражаются желудочно-кишечный тракт и почки, а также печень и слюнные железы, т. е. органы, через которые ртуть выделяется. При отравлении солями ртути ощущаются металлический привкус во рту, жгучие боли в пищеводе и желудке, наблюдается рвота и кровавый понос. Смертельной дозой сулемы или других растворимых солей ртути при введении в желудок считают 0,2 — 0,3 г. При внутривенном введении эта доза примерно в 2 раза меньше.
Продолжительность течения ртутной интоксикации различна. Смерть обычно наступает через 5-10 суток и позже. Из организма ртуть выводится с мочой, калом, а также железами: слюнными, потовыми, молочными и др. Выделение ртути протекает медленно. Через 2 недели после введения часть введенного количества ртути еще остается в организме.
Летальность при отравлениях препаратами ртути высокая. При отравлениях хлоридом окисной ртути она составляет 60 — 84%. В качестве противоядий при отравлениях ртутными препаратами применяют унитиол (2,3-димеркаптопролан-сульфонат натрия), и венгерский препарат дикаптол.
Ртуть откладывается в печени, почках, меньше в других органах и тканях. Она может быть обнаружена в человеческом организме и в норме.
При исследовании дробным методом печени и почек 71 трупа естественное содержание ртути в -печени определялось в пределах 0- 0,001 мг, а в почках — 0,04 мг в 100 г органа. Наибольшие количества естественно содержащейся ртути обнаруживаются в почках, несколько меньше в печени и других органах. Как естественное содержание определялось 2,4 мкг в 200 мл мочи.
Диагноз отравления соединениями ртути затруднен. Острое отравление часто принимают за желудочно-кишечное расстройство. Самым достоверным способом является химическое обнаружение и определение ртути в моче, рвотных массах, экскрементах, слюне.
Патологоанатомическая картина может дать наводящие указания лишь при типичных изменениях внутренних органов: от покраснения и набухания слизистых оболочек пищевода или желудка до некроза в виде белого или серого струпа, изменения в толстой кишке и нижних отделах тонких кишок от геморрагически-серозного воспаления до некрозов с образованием язв.
В случаях, когда отравление длилось от 5 до 14 дней, типичную картину сулемового нефроза представляют почки. Для заключения о смерти от ртутного отравления судебно-медицинскому эксперту и судебно-следственным органам существенную помощь оказывают данные химико-токсикологического анализа.
Органические препараты ртути
В последние годы широкое применение в народном хозяйстве приобрели органические соединения ртути, например этилмеркурхлорид, фенилмеркурацетат, фенилмеркурбромид и др.
Этилмеркурхлорид C2H5HgCl представляет собой белый порошок с температурой плавления 192,3° и специфическим запахом. В воде практически нерастворим, хорошо растворим в горячем спирте и 10% растворе едкого натра.
Изолирование ртутьорганических соединений из внутренних органов трупа, мочи, крови, объектов растительного происхождения (зерно) при химико-токсикологическом анализе основано на извлечении их 3 — 9 М. раствором кислоты соляной, экстракции хлороформом, качественном обнаружении и количественном (спектрофотометрическом) определении в виде этилмеркурдитизоната.
Токсикологическое значение органических препаратов ртути обусловлено как широким применением ртутьорганических соединений, так и очень высокой токсичностью их.
Многие ртутьорганические соединения, в том числе этилмеркурхлорид и препараты на его основе, широко используются в сельском хозяйстве для предпосевной обработки (протравливания) семян зерновых и других культур.
Ртутьорганические препараты применяются для пропитки стройматериалов в целях консервирования, для предохранения альбуминовых и казеиновых клеев от плесневых грибов.
В медицине некоторые ртутьорганические соединения используются в качестве диуретиков, для стерилизации инструментов, при обработке поверхности ран, в качестве противораковых средств.
В химических лабораториях с их помощью получают органические производные других элементов, решают важные теоретические проблемы химии.
По токсичности органические препараты ртути превосходят препараты неорганические. Симптомы отравления при действии органических препаратов ртути на организм не зависят от пути введения их и характеризуются острым поражением центральной нервной и сердечно-сосудистой систем.
Более высокая токсичность органических препаратов ртути объясняется тем обстоятельством, что органический радикал способствует проникновению их в липоиды мозга, что приводит к тяжелому поражению центральной нервной системы.
Клиническая картина отравлений органическими препаратами ртути не всегда характерна. Симптомы отравления часто затягиваются и напоминают желудочно-кишечные заболевания, что иногда приводило к постановке неправильного диагноза (пищевое отравление, дизентерия, туберкулезный менингит, глистная интоксикация, брюшной тиф, вирусный грипп и др.), к неправильному лечению и невозможности принять своевременные меры по спасению жизни пострадавшего. Большую помощь в диагностике отравления оказывает своевременно сделанный анализ мочи больного.
Органические препараты ртути обладают кумулятивными свойствами, долго задерживаются в организме и особенно в ткани мозга, и медленно выводятся из него. Опытами на курах и крысах было установлено, что ЭМХ хорошо всасывается из пищеварительного тракта, практически не разрушается, накапливается в печени и других жизненно важных органах, медленно и равномерно выделяется почками; с каловыми массами выделяются меньшие количества его, чем при введении неорганических препаратов ртути. Одним из путей выведения органических производных ртути являются волосы (шерсть).
Патологоанатомическая картина не всегда выявляет отравление препаратами ртути, иногда скорее напоминает отравление мышьяком, а потому судебно-медицинские эксперты для заключения о причинах смерти при подозрении на отравление ртутными препаратами обращаются к химико-токсикологическому исследованию.
При изолировании ртути из биологического материала общими методами минерализации потери её за счёт улетучивания в условиях высоких температур могут достигать более 90 %. В связи с этим, проводят только частичное разрушение органических веществ, или так называемую деструкцию.
По 20 г средней пробы печени и почек раздельно (исследование смеси органов не допускается) помещают в две колбы ёмкостью 200 мл. В каждую колбу приливают 5 мл воды, 1 мл этанола, 10 мл кислоты азотной концентрированной.
К смеси добавляют по каплям 20 мл кислоты серной концентрированной с такой скоростью, чтобы постоянно поддерживать реакцию разложения кислоты азотной, но окислы азота не выделялись из колбы. Колбу оставляют при комнатной температуре на 5 – 10 мин до прекращения выделения окислов азота, затем нагревают на кипящей водяной бане в течение 10 мин. При бурном течении реакции в колбу добавляют 30 – 50 мл воды. Горячий деструктат смешивают с двойным объёмом горячей воды и, не охлаждая, фильтруют через двойной предварительно увлажнённый фильтр в колбу, содержащую 20 мл насыщенного раствора мочевины (для связывания окислителей).
O = C (NH2)2 + 2 HNO3 ® N2 + 2 NO + CO2 + 3 H2O
O = C (NH2)2 + 2 HNO2 ® 2 N2 + CO2 + 3 H2O
Фильтр и остатки жира промывают 1 – 2 раза горячей водой. Промывные воды объединяют с деструктатом. После охлаждения жидкость разбавляют водой в мерной колбе на 200 мл и определяют ртуть.
Для обнаружения ртути в деструктате применяют реакции с дитизоном и с взвесью меди (I) йодида. Реакцию с дитизоном также применяют для фотоколориметрического определения ртути, а реакцию со взвесью меди (I) йодида используют и для визуального нефелометрического определения ртути в деструктате.
1.Реакция с дитизоном
Фотоэлектроколориметрическое определение ртути (
в CCl4_ зеленый цвет в CCl4_ оранжевый цвет
в CCl4_ зеленый цвет в CCl4_ оранжевый цвет
2. Реакция с меди (I) йодидом
Выделение ртути из деструктата проводится с использованием йодида меди (I):
Hg2+ + 4 CuI ® Cu2[HgI4] ¯ + 2 Cu+
Для полного осаждения ртути вводят избыток CuI. Колориметрическое определение проводят после проведения ртути из осадка Cu2[HgI4] в растворимый комплекс К2[HgI4]
Cu2[HgI4] + 2КI/I2 
В присутствии ионов ртути взвесь окрасится в розовый или красный цвет.
Токсикологическое значение В промышленности различные препараты сурьмы Sb2О5; Sb2S5 — применяются при изготовлении эмалированной по гончарных изделий, стекла, текстильных и резиновых предметов огнеупорных тканей, брезента и в других отраслях. Ряд препаратов сурьмы, как, например, пятнистая сурьма, сурьмин, стибенил, неостибозан, солюсурьмин и др., используются в медицине.
Описаны случайные медицинские, пищевые, производственные и даже умышленные отравления препаратами сурьмы.
Клиническая картина отравления сурьмой сходна с клиникой отравления соединениями мышьяка. Смертельная доза тартрата антимонилкалия для человека при введении через рот составляет
При патологоанатомическом исследовании трупа отмечаются гиперемия легких, расстройство кровообращения, кровоизлияния в легких и органах желудочно-кишечного тракта.
Опытами на животных установлено, что сурьма может накапливаться в почках и главным образом в печени. По дани А. О. Войнара, в органах человека и млекопитающих сурьма естественно содержащийся элемент не обнаружена.
1. Реакция с малахитовым зеленым (основная реакция)
Эта реакция основана на том, что малахитовый зелёный (равно как и бриллиантовый зелёный), являющийся основным красителем, образует с ацидокомплексом сурьмы ионный ассоциат, который экстрагируется толуолом, окрашивая его в синий или голубой цвет.
Сурьма, находящаяся в минерализате в степени окисления 3+, окисляется натрия нитритом до степени окисления 5+ и с кислотой хлороводородной даёт ацидокомплекс, который и вступает в реакцию.
HSbO2 + NaNO2 + HCl ® HSbO3 + NO + NaCl + H2O
HSbO3 + 6 HCl ® HSbCl6 + 3 H2O
В присутствии сурьмы слой толуола окрашивается в сине–голубой цвет, а водный слой – в оранжевый. Толуольное извлечение отделяют, встряхивают его в течение 5 сек с 3 мл 25 % раствора кислоты серной. Голубая окраска толуольного слоя должна сохраниться.
В качестве подтверждающей реакции рекомендуется реакция образования сурьмы сульфида.
2. Реакция образования сурьмы сульфида
Sb2(SO4)3 + 3 Na2S ® Sb2S3 ¯ + 3 Na2SO4
В присутствии сурьмы появляется оранжевый осадок.
Соединения мышьяка на протяжении веков привлекали, да и сейчас продолжают привлекать внимание фармацевтов, токсикологов и экспертов-химиков. Проф. А. В. Степанов, характеризуя мышьяк как яд, отмечал, что судебная химия делала на нем свои первые шаги.
В руководствах по судебной (токсикологической) химии мышьяку всегда уделялось большое внимание. При разработке методов минерализации критерием для их оценки всегда являлось наиболее полное обнаружение и определение мышьяка (и ртути). В настоящее время, несмотря на появление большого количества веществ, представляющих токсикологический интерес, мышьяк и его соединения не утратили своего значения. Причиной этого является широкое применение различных препаратов мышьяка в народном хозяйстве и медицине и их токсичность.
Особенно велико в настоящее время значение следующих препаратов мышьяка: мышьяковистого ангидрида (AS2O3), применяемого в качестве инсектицида и консерванта в сельском хозяйстве, в стекловарении для обесцвечивания стекла, в кожевенной промышленности, медицине и т. д., а смесь натриевых солей орто — и метамышьяковистых кислот (Na3AsО3 и NaAsО2), применяемых в сельском хозяйстве в качестве инсектицидов.
Изумрудно-зеленая окраска содержимого желудков трупов животных, пищевых продуктов и других объектов исследования неоднократно являлась наводящим указанием для исследования их на наличие мышьяка и меди. Имеют токсикологическое значение и медицинские препараты мышьяка: Фаулеров раствор, натрия арсенат, миарсенол, новарсенол, осарсол и др.
Представляет токсикологический интерес и газообразный мышьяковистый водород, который может быть причиной как производственных, так и бытовых отравлений.
Соединения мышьяка издавна являлись орудиями преступления, что было связано с их повсеместной известностью, доступностью для широких слоев населения, отсутствием запаха, сладковатым вкусом таких препаратов, как, например, мышьяковистый ангидрид. Сходство картины отравления мышьяком с течением некоторых тяжелых хронических заболеваний, особенно когда небольшие дозы яда давались в течение длительного времени, приводило к тому, что отдельные преступления оставались нераскрытыми.
Причинами отравлений соединениями мышьяка в настоящее время могут быть неосторожное, небрежное или халатное отношение к хранению и применению препаратов мышьяка в народном хозяйстве, недостаточно четко поставленная техника безопасности и другие упущения. Не исключена возможность и медицинских отравлений.
Соединения мышьяка обладают как местным, так и общим действием на организм. Введенный внутрь мышьяк связывается с SH-группами ферментов и нарушает процессы окислительного фосфорилирования. Местно действует прижигающе, вызывая воспаление и омертвение тканей. На некротизирующем действии мышьяка основано применение мышьяковистого ангидрида в зубоврачебной практике.
При введении токсических доз препаратов мышьяка внутрь наступает отравление. Различают две основные формы отравления: желудочно-кишечную и нервную. Чаще наблюдается смешанная форма. При первой форме отравления появляются металлический привкус во рту, жжение в зеве, жажда, сильные боли в животе, неукротимая рвота, тяжелый понос.
При нервной форме в период от нескольких дней до нескольких недель развивается типичный мышьяковый неврит с парестезией конечностей и языка, иногда довольно стойкими параличами.
Мышьяк выделяется с мочой и калом, слюной, желчью, молоком. Процесс ускоряется под влиянием димеркаптола. Через неповрежденную кожу мышьяк и его соли не всасываются.
Смертельная доза для неорганических препаратов мышьяка составляет 0,05-0,1 г. Однако иногда и большие дозы могут не привести к смерти. Отмечают как повышенную чувствительность к мышьяку, так и привыкание к нему. Мышьяк обладает способностью кумулироваться.
Если при остром отравлении он концентрируется в основном в желудочно-кишечном тракте и паренхиматозных органах, то при хроническом отравлении накапливается преимущественно в костях и ороговевших тканях (волосы, ногти, кожа).
Патологоанатомическая картина при быстро протекающих отравлениях нехарактерна. При медленно текущих отравлениях отмечают жировое перерождение печени, почек, сердечной мышцы, местами кровоизлияния в серозных оболочках, жидкое (в виде рисового отвара) содержимое кишечника.
Мышьяк хорошо сохраняется в биологическом материале и может быть обнаружен в ней: через несколько лет после смерти.
Большое значение придают количественному определению» мышьяка в органах, так как он относится к числу чрезвычайно распространенных в природе элементов, содержится в почве, воде и т. п. При судебно-химических исследованиях эксгумированных трупов в лабораторию вместе с органами должны быть доставлены образцы земли, изъятой из шести участков с места захоронения (над гробом, под гробом, у боковых поверхностей и концов гроба), а также части одежды, украшения и доски гроба.
Содержание мышьяка в серной кислоте может привести к попаданию его в патоку и другие пищевые продукты. В животных и растительных продуктах, например в сырых плодах и овощах, мышьяк может содержаться в значительных количествах. Количество мышьяка, принимаемое человеком с пищей, в зависимости от состава ее колеблется и может достигать 1 мг в сутки. По данным Войнара, содержание мышьяка в органах человека колеблется в пределах 0,008—0,2 мг в 100 г сырого органа, а содержание мышьяка в коже и волосах может достигать 600 мг в 100 г.
В большинстве случаев результаты химико-токсикологического исследования помогают решить вопрос, в какой форме или каким путем попал мышьяк в объект исследования. Примерами этому может служить следующее:
а) совместное обнаружение в объекте исследования мышьяка и меди при отравлениях швейнфуртской зеленью;
б) одновременное нахождение мышьяка в органах эксгумированного трупа и в земле кладбища или нахождение мышьяка в органах трупа и ненахождение его в земле кладбища.
Для исследования на растворимые и, следовательно, способные проникнуть в труп соединения мышьяка из земли, находящейся вокруг гроба, 200-500 г земли последовательно извлекают водой, водным раствором аммиака и кислотой соляной. Вытяжки подвергают минерализации и исследуют на мышьяк.
в) Одновременное обнаружение мышьяка после минерализации, например, мочи, и получение азокрасителя при наличии в ней органических препаратов мышьяка. Для второй реакции 10 мл мочи подкисляют соляной кислотой, охлаждают до 0°, добавляют осторожно 4-5 капель 0,5 % раствора натрия нитрита и наслаивают 5 мл 1% раствора резорцина — красное кольцо на границе слоев указывает на наличие в исследуемом материале аминогруппы.
г) Обнаружение в объекте исследования крупинок мышьяковистого ангидрида. Крупинки мышьяковистого ангидрида трудно растворимы в воде, возгоняются, давая кристаллические возгоны (тетраэдры и октаэдры), а при нагревании с углем восстанавливают до металлического мышьяка. Растворы кислоты соляной дают и другие качественные реакции на ион мышьяка.
Применяемые в химико – токсикологическом анализе методы обнаружения мышьяка основаны на переведении его в гидрид мышьяка и на последующем определении гидрида мышьяка при помощи реакций Зангер – Блека и реакции Марша. При этих реакциях из соединений мышьяка выделяется гидрид мышьяка, который летуч и ядовит. Поэтому при выполнении данных реакций требуется особая осторожность.
Классическими методами обнаружения мышьяка при химико- токсикологическом анализе является: метод Марша, предложенный английским химиком Джеймсом Маршем 1836 г.
Достоинствами способа являются:
1) возможность многократной проверки наличия или отсутствия мышьяка в исследуемой пробе;
2) наглядность, доказательность, специфичность.
В то же время обнаружение мышьяка по методу Марша требует затраты значительного количества времени эксперта–химика – более 3-х часов.
Поэтому в качестве ориентирующей реакции, имеющей только отрицательное значение, в дробном обнаружении мышьяка введена реакция Зангер – Блека, проведение которой осуществляется в течение 60 мин.
Реакция Зангер – Блека неспецифична для мышьяка, что ограничивает значение её в токсикологической химии, но высокочувствительна. Чувствительность реакции достигает 0,1 мкг мышьяка в исследуемом объёме. При отрицательном результате этой чувствительной реакции отпадает необходимость в проведении реакции Марша. При положительном результате, подтверждение обнаружения мышьяка реакцией Марша является обязательным.
Реакция Зангер – Блека позволяет сочетать качественное обнаружение мышьяка (при его малых количествах) с полуколичественным определением. Метод основан на восстановлении соединений мышьяка до гидрида мышьяка, который затем реагирует с хлоридом или бромидом ртути (II). Реакция выполняется в специальном приборе (рис. 1).
Восстановление соединений мышьяка производится водородом в момент его выделения, который получают при взаимодействии металлического цинка с кислотой серной:
H2SO4 + Zn ® ZnSO4 + 2 H
Металлический цинк и кислота серная, применяемые для получения водорода должны быть судебнохимически чистые (схч), т.е. не содержать мышьяка.
Для ускорения реакции между цинком и кислотой серной применяют «купрированный» цинк. Куприрование осуществляется погружением цинка на несколько минут (до потемнения цинка) в 0,05 % раствор меди (II) сульфата с последующим промыванием водой. Куприрование необходимо потому, что чистый цинк плохо реагирует скислотой серной.
Рис. 1. Прибор Зангер – Блека
2 – насадка с тампоном ваты, пропитанной раствором свинца ацетата;
3 – бумага, обработанная раствором ртути (II) хлорида;
4 – ватный тампон;
5 – проявленная реактивная бумага.
Водород, образовавшийся при взаимодействии кислоты серной и цинка, восстанавливает соединения мышьяка до арсина (AsH3).
AsO2– + 7 H+ ® AsH3 + 2 H2O
AsO33– + 9 H+ ® AsH3 + 3 H2O
AsO43– + 11 H+ ® AsH3 + 4 H2O
Скорость восстановления соединений трёх– и пяти–валентного мышья-ка (арсенитов и арсенатов) водородом различна. Арсениты восстанавливаются водородом легче, чем арсенаты. В присутствии солей железа (II) или олова (II) арсенаты легко восстанавливаются в арсениты.
AsO43– + Sn2+ + 4 H+ ® AsO2– + Sn4+ + 2 H2
AsO2– + 7 H+ ® AsH3 + 2 H2O
Образовавшийся гидрид мышьяка реагирует с хлоридом или бромидом ртути (II), которым пропитана фильтровальная бумага. В результате этой реакции образуется ряд окрашенных соединений, которые окрашивают бумагу в виде жёлтого или коричневого пятна:
AsH3 + HgCl2 ® AsH2(HgCl) + HCl
AsH3 + 2 HgCl2 ® AsH (HgCl) 2 + 2 HCl
AsH3 + 3 HgCl2 ® As (HgCl) 3 + 3 HCl
AsH3 + As(HgCl)3 ® As2Hg3 + 3 HCl
Сероводород, выделяющийся при взаимодействии водорода с кислотой серной реагирует с хлоридом или бромидом ртути (II). В результате этой реакции образуется ртути (II) сульфид тёмно–коричневого цвета, который маскирует, имитирует окраску пятен. Для связывания сероводорода применяют вату, пропитанную раствором свинца ацетата:
H2S + Pb(CH3COO)2 ® PbS + 2 CH3COOH
В колбу прибора Зангер – Блека (рис. 1) вносят 4 мл минерализата, 10 мл 25 % раствора серной кислоты, 5 мл воды, 1 мл 10 % раствора олова (II) хлорида в 50 % растворе серной кислоты и 6 – 8 гранул купрированного цинка. Колбу закрывают насадкой, в которую вложена бумага, пропитанная ртути хлоридом, а ниже вставлен тампон ваты, пропитанный раствором свинца ацетата. Через 60 мин реактивную бумажку извлекают, отмечают окраску пятна. В зависимости от количества мышьяка, находящегося в объекте исследования, бумажка окрашивается в цвета от светло–жёлтого до тёмно–коричневого.
Реакция Марша основана на восстановлении соединений мышьяка водородом в момент его выделения и на последующем термическом разложе-нии образовавшегося при этом гидрида мышьяка:
AsO2– + 7 H+ ® AsH3 + 2 H2O
2 AsH3 
Обнаружение мышьяка проводится на приборе Марша (рис. 2). Прибор Марша в современном варианте состоит из нескольких частей: конической колбы ёмкостью 150 мл, к горлу которой пришлифована капельная воронка и стеклянная трубка, согнутая под прямым углом; хлор–кальциевой трубки; восстановительной трубки, обычно называемой трубкой Марша. Восстановительная трубка изготавливается из тугоплавкого стекла или кварца и имеет в нескольких местах сужения (диаметр 1,5 мм), при внутреннем диаметре трубки 4 – 5 мм, а конец её согнут почти под прямым углом и оттянут.
Работа на приборе Марша включает три этапа.
1. Сборка прибора и вытеснение из него воздуха водородом
В колбу прибора Марша помещают 10 г купрированного цинка. В хлоркальциевую трубку помещают безводный гранулированный кальция хлорид, который предназначен для осушения водорода и арсина (AsH3), выходящих из колбы. Колбу, хлоркальциевую и восстановительную трубки соединяют друг с другом (встык) резиновыми трубками. Собранный таким образом прибор Марша должен быть герметичным. В капельную воронку прибора наливают 20 мл 10 % раствора кислоты серной, которую небольшими порциями (по 4 – 5 мл) приливают к «купрированному» цинку. В капельной воронке необходимо оставлять 8 – 10 мл раствора кислоты серной, которая препятствует попаданию воздуха в прибор Марша. Воздух может быть причиной взрыва прибора при нагревании восстановительной трубки или при зажигании выходящих из неё газов. В течение 15 – 20 мин из прибора вытесняют воздух. Чтобы убедиться в полноте вытеснения воздуха водородом из прибора Марша, над выходным отверстием восстановительной трубки помещают узкую пробирку донышком вверх. Через 4 – 5 мин пробирку закрывают пальцем и, не переворачивая её, относят от прибора и зажигают. В случае, если воздух из прибора вытеснен, водород вспыхивает без взрыва (без хлопка).
2. Проверка прибора и реактивов на отсутствие мышьяка
После удаления воздуха из прибора приступают к проверке наличия мышьяка в реактивах (кислоте серной, цинке) и посуде. Для этой цели:
а) зажигают водород у открытого конца восстановительной трубки. При наличии мышьяка пламя приобретает синеватую окраску;
б) восстановительную трубку в широкой части её нагревают до слабо–красного каления, а суженное место восстановительной трубки за нагреваемым широким участком охлаждают. Через час проверяют охлаждаемую часть восстановительной трубки на отсутствие буровато–серого налёта металлического мышьяка.
При отрицательных результатах испытания аппарата и реактивов в течение часа переходят к исследованию минерализата.
3. Исследование минерализата
Смешивают 
В процессе исследования в приборе Марша проводят ряд реакций и наблюдений.
1. Отставив горелку от нагретой части трубки и охладив её, наблюдают, не окрашено ли пламя у конца восстановительной трубки в синеватый цвет, характерный для мышьяковистого водорода; не ощущается ли запах чеснока, не появляется ли буровато–серый налёт при внесении холодных частей фарфоровой пластинки в пламя восстановительной трубки.
2. Пламя водорода восстановительной трубки тушат и к отверстию оттянутого конца подносят фильтровальную бумагу, смоченную 2 – 5 % раствором серебра нитрата. Наблюдают, не появится ли почернение бумаги в результате образования металлического серебра:
AsH3 + 3 AgNO3 ® AsAg3 + 3 HNO3
AsAg3 + 3 AgNO3 ® AsAg3 × 3 AgNO3
AsAg3 × 3 AgNO3 + 3 H2O ® 6 Ag + H3AsO3 + 3 HNO3
Горелку вновь подставляют под трубку Марша и продолжают исследование в течение часа. По истечении указанного времени смотрят, не появилось ли серовато–бурого налёта с металлическим блеском в охлаждаемой части восстановительной трубки. Если значительный тёмный налёт образуется раньше, то не обязательно нагревать в течение часа.
Исследование тёмного налёта. В случае получения плотного налёта, его подвергают дополнительному исследованию, т.к. налёты могут давать и другие вещества (сурьма, селен, сера, уголь и др.). Для чего восстановительную трубку отсоединяют от прибора Марша и место налёта осторожно нагревают. Металлический мышьяк и сурьма при этом окисляются и откладываются в виде белого налёта оксидов (As2O3 и Sb2O3) в холодных местах восстановительной трубки. При рассматривании налёта под микроскопом при наличии мышьяка видны характерные кристаллы мышьяковистого ангидрида As2O3 в виде октаэдров (рис. 3), а оксид сурьмы аморфный. Образование кристаллов октаэдрической формы является одним из важнейших доказательств наличия мышьяка в минерализате, а микрофотография кристаллов может служить доказательством правильности выводов эксперта–химика об обнаружении мышьяка в объектах исследования.
В случаях, когда налёт мышьяковистого ангидрида в трубке Марша не имеет ясно выраженного кристаллического строения, что бывает при количествах мышьяка менее 0,05 мг, поступают следующим образом: налёт мышьяковистого ангидрида растворяют в 2 – 3 каплях 50 % раствора кислоты азотной и переносят на предметное стекло. Раствор осторожно упаривают досуха. Сухой остаток растворяют в 1 – 2 каплях 10 % раствора кислоты хлороводородной, в раствор вносят 1 – 2 кристалла цезия хлорида (CsCl), а затем, через некоторое время, если никакого осадка не появилось (отсутствие сурьмы), добавляют несколько кристаллов калия йодида – при наличии мышьяка выпадает ярко–красный осадок: Cs2AsI5 × 2,5 H2O, имеющий под микроскопом вид шестилучевых звёздочек и шести-угольников. Кристаллы Cs2AsI5 × 2,5 H2O по своему виду напоминают Cs2SbI5 × 2,5 H2O.
При действии пиридина на красный осадок Cs2AsI5 × 2,5 H2O последний растворяется, а по краям образуются зеленовато–жёлтые игольчатые кристаллы. При наличии сурьмы кристаллы Cs2SbI5 × 2,5 H2O теряют окраску, но сохраняют форму (рис. 3).
Рис. 3. Микрокристаллические реакции на мышьяк и сурьму
Кристаллы мышьяковистого ангидирида
Мышьяк с цезия хлоридом.
Лекция «4 Причины распада древней Руси» также может быть Вам полезна.
🔥 Видео
Производство судебно-медицинской экспертизы (обследования) в отношении живого лица; коммуникацияСкачать

Беседа вторая. Определения, термины и механизмы тупой травмы в судебно-медицинской экспертизеСкачать

Топ 10 самых смертоносных веществ. Сравнение токсичностиСкачать

03. Повреждения тупыми предметами. СМЭСкачать

20 глупых вопросов СУДМЕДЭКСПЕРТУ | Алексей РешетунСкачать

Вопросы судебно медицинской травматологииСкачать

Судебно-почвоведческая экспертиза | Лекции по криминалистике – судмедэксперт Игорь Морозов | НаучпопСкачать

СУДЕБНО МЕДИЦИНСКОЕ ИССЛЕДОВАНИЕ ВЕЩЕСТВЕННЫХ ДОКАЗАТЕЛЬСТВ БИОЛОГИЧЕСКОГО ПРОИСХОЖДЕНИЯСкачать

01. Цели, задачи и предмет. СМЭСкачать

Предмет судебной медицины определение, содержание, задачи Объекты, методы исследования и историяСкачать

Краткая история 15 ФАКТОВ О ЯДАХ И ОТРАВИТЕЛЯХСкачать

Видео-лекция "Судебная психологическая экспертиза"Скачать

Назначение и проведение судебных экспертиз. Лекция Михайлова М.А.Скачать

13 Тактика подготовки и назначения экспертизыСкачать









































