В июле 2020 года стартовал последний этап обязательной маркировки лекарственных препаратов и фармацевтических товаров. Однако в отдельных случаях можно получить отсрочку. Для этого необходимо обратиться в Росздравнадзор за специальным согласованием, которое дает право отгружать, принимать и продавать медикаменты без штрих-кода Data Matrix. Что еще нужно знать о маркировке лекарств? Вся необходимая информация — в нашей статье.
- Обязательная маркировка лекарственных препаратов с 2020 года
- СПРАВКА
- Код маркировки лекарств: что это и для чего нужен
- ВАЖНО
- ВНИМАНИЕ
- Какие лекарства подлежат маркировке с 2020 года
- ВАЖНО
- Этапы и сроки маркировки лекарственных средств
- ВНИМАНИЕ
- СПРАВКА
- Требования к маркировке лекарственных средств
- Как подключиться к системе маркировки лекарственных средств
- Что делать с немаркированными лекарствами
- Штрафы за лекарства без маркировки
- Маркировка лекарственных средств
- Что вы узнаете
- Закон о маркировке лекарств
- Сроки
- Участники маркировки лекарств
- Производители
- Дистрибьюторы
- Аптеки
- Медцентры
- Схема работы
- Код маркировки — что это и как выглядит?
- Штрафы
- Как зарегистрироваться в системе маркировки?
- Аптекам
- Что нужно для маркировки
- Как принимать
- Как продавать
- Приложение на ваш смартфон
- 2D-cканер от 3 100 ₽
- Терминал сбора данных от 22 850 ₽
- Дистрибьюторам
- Стоматологиям и медцентрам
- Что нужно для маркировки
- Как принимать
- Как списывать
- Как получить регистратор выбытия?
- Обязательная маркировка лекарств в 2020 году: руководство для участников оборота
- Какие нормативно-правовые акты регулируют маркировку лекарств
- Как работает ФГИС МДЛП
- Каким требованиям должны отвечать участники оборота лекарственных препаратов
- Порядок регистрации в системе маркировки лекарств
Видео:Маркировка лекарственных средствСкачать

Обязательная маркировка лекарственных препаратов с 2020 года
В ней задействованы участники рынка лекарственных средств (ЛС): производители, импортеры, оптовики, аптеки и медучреждения. Все они обмениваются данными с государственной информационной системой (ГИС) мониторинга «Честный знак»:
- изготовители и импортеры получают коды для новых фармизделий, и наносят марки на упаковку. Помимо этого, маркируют каждый мешок, ящик, бочку и прочую транспортную (третичную) тару с лекарствами. Сведения об этом передают в систему мониторинга;
- оптовики сообщают в «Честный знак» о том, что ЛС получены, третичная тара расформирована, медикаменты отгружены другому оптовику, в аптеку или в медучреждение;
- аптеки передают в «Честный знак» данные о приеме лекарств, о продаже потребителям или о списании;
- медицинские учреждения информируют ГИС мониторинга о получении фармпродукции, о ее внутреннем перемещении и о выбытии.
Подключиться к системе электронного документооборота для целей обязательной маркировки Подать заявку
СПРАВКА
ТПоставщик и получатель лекарств могут договориться, какой способ передачи данных в систему применять: прямой или обратный. Прямой подразумевает, что поставщик сообщает сведения, а получатель их подтверждает. При обратном способе — наоборот. Получатель передает данные, а поставщик их подтверждает.
Видео:Маркировка лекарственных препаратов Пошаговая инструкция.Скачать

Код маркировки лекарств: что это и для чего нужен
Уникальный двумерный штриховой код Data Matrix — это последовательность цифр и букв. Он составлен из двух кодов: идентификации и проверки.
У кода идентификации две части. Первая — международный код товара GTIN, в нем 14 символов. Вторая — индивидуальный серийный номер, в котором 13 символов.
ВАЖНО
GTIN и индивидуальный серийный номер ЛС надо дублировать в виде читаемого печатного текста. То есть на медикаменты следует наносить не только штрих-код, но и текстовый фрагмент. Отметим, что подобного требования нет ни для табачной, ни для обувной продукции.
Код проверки — это электронная подпись (ее также называют крипто-хвостом). Она складывается из ключа (4 символа) и значения кода (44 символа). При помощи данной подписи можно проверить, является ли оборот ЛС законным.
Электронную подпись для работы в системах обязательной маркировки можно получить через час Заказать подпись
ВНИМАНИЕ
Data Matrix размещается на потребительской упаковке препарата. Например, на картонной коробке. Если ее нет, код наносят на первичную упаковку: блистер, ампулу и проч. Возможен и другой вариант — напечатать код на этикетке, если ее нельзя отделить от упаковки без повреждений. Плюс к этому маркировке подлежит транспортная (третичная) упаковка с фармпродукцией. На нее наносят не Data Matrix, а групповой штрих-код. Он не обязательно двумерный, допустимо сделать его линейным.
Видео:Маркировка лекарственных средств. Рассказывает Анастасия Макова.Скачать

Какие лекарства подлежат маркировке с 2020 года
Для некоторых лекарственных средств обязательная маркировка началась уже в 2019 году. Речь идет о ЛС для так называемых высокозатратных нозологий (ВЗН). К ним относятся препараты для лечения:
- Гемофилии.
- Муковисцидоза.
- Гипофизарного нанизма.
- Болезни Гоше.
- Злокачественных новообразований лимфоидной, кроветворной и родственных им тканей.
- Рассеянного склероза.
- Лиц после трансплантации органов и (или) тканей.
Особенности маркировки препаратов для лечения ВЗН утверждены постановлением Правительства от 14.12.18 № 1557.
Но основная часть медикаментов подпадает под маркировку с 1 июля 2020 года. Это следует из статьи 67 Федерального закона от 12.04.10 № 61-ФЗ «Об обращении лекарственных средств» (далее — Закон № 61-ФЗ).
Нюансы прописаны в Положении о системе мониторинга движения лекарственных препаратов для медицинского применения (утв. постановлением Правительства от 14.12.18 № 1556; далее — Положение о мониторинге лекарств).
ВАЖНО
Как определить, нужно ли маркировать тот или иной медикамент? Необходимо зайти на сайт государственного реестра лекарственных средств и сделать запрос на конкретное наименование. Если данная позиция в реестре не значится, то маркировка не нужна. Такие разъяснения дает Росздравнадзор в ответах на частные обращения.
Видео:Маркировка лекарственных средствСкачать

Этапы и сроки маркировки лекарственных средств
Выделяют четыре этапа внедрения маркировки.
Этап 1: с 1 июля 2019 года.
Участники оборота лекарств, предназначенных для лечения семи перечисленных выше высокозатратных нозологий, регистрируются в системе мониторинга «Честный знак».
Этап 2: с 1 октября 2019 года.
Стартует обязательная маркировка семи медикаментов для ВЗН. При этом указанные ЛС, произведенные до 31 декабря 2019 года, разрешалось хранить, перевозить, отпускать, продавать и применять без знаков идентификации до истечения срока годности. Об этом сказано в части 7.1 статьи 67 Закона № 61-ФЗ.
Этап 3: с 1 января по 29 февраля 2020 года.
У всех участников оборота лекарств (а не только у работающих с медикаментами для ВЗН) появляется обязанность по регистрации в ГИС мониторинга «Честный знак». Те, кто присоединились к обороту ЛС после 29 февраля, обязаны пройти регистрацию в течение 7 календарных дней с начала соответствующей деятельности.
Этап 4: с 1 июля 2020 года.
В общем случае маркировка становится обязательной для всех медицинских препаратов. Изготовители и импортеры при фасовке лекарств наносят на их упаковку код Data Matrix. Все участники рынка ЛС передают в систему мониторинга данные об операциях с медикаментами.
ВНИМАНИЕ
В период с 1 июля 2020 до 1 января 2021 года действуют особые правила. Их применяют к отечественным ЛС, изготовленным в июле, августе и сентябре 2020 года, а также к импортным препаратам (кроме тех, что предназначены для семи ВЗН), произведенным до 1 октября 2020 года. Такие медикаменты можно ввозить в страну и вводить в гражданский оборот без маркировки, если получить в Росздравнадзоре специальное согласование. Его выдают на срок 45 дней (постановление Правительства от 30.06.20 № 955).
Оператор системы мониторинга (это Центр развития перспективных технологий, сокращенно ЦРПТ) берет плату за предоставление кодов маркировки. Одна марка обойдется в 50 копеек без НДС. На жизненно необходимые препараты с предельной отпускной ценой производителя не более 20 руб. коды выдаются бесплатно (см. « Утвержден размер платы за оказание услуг по маркировке продукции »).
СПРАВКА
С начала обязательного этапа маркировки аптекам, которые ранее являлись плательщиками ЕНВД, приходится переходить на иные режимы налогообложения. Основание — статья 346.27 НК РФ. Из нее следует, что розничные торговцы товарами, подлежащими обязательной маркировке, не могут оставаться на «вмененке». Им необходимо сняться с учета в качестве плательщика ЕНВД, и перейти на общий режим налогообложения или УСН. Подробнее об этом см.:
Для отказа от ЕНВД надо подать заявление по форме ЕНВД-3.
Подать заявление по форме ЕНВД‑3 через интернет и сдавать отчетность по УСН или ОСНО
Видео:Маркировка лекарственных средств (МДЛП). Как я пообщался с "Честным знаком" :)Скачать

Требования к маркировке лекарственных средств
Всем участникам лекарственного оборота следует пройти регистрацию в ГИС мониторинга. Для этого нужно приобрести усиленную квалифицированную электронную подпись (УКЭП). Также она необходима для подтверждения передачи данных в «Честный знак».
Аптекам потребуется ККТ с прошивкой, которая поддерживает тег для маркированной продукции. На кассе должно быть установлено программное обеспечение, способное передавать оператору фискальных данных (ОФД) чеки с кодом Data Matrix. У такого оператора должен быть модуль маркировки. Еще необходим 2D-сканер для считывания штрих-кода.
Полный комплект для онлайн‑ККТ: касса по спеццене, ОФД, настройка ККТ с регистрацией в ФНС и товароучетная система со скидкой Отправить заявку
Производителям нужно получить от ЦРПТ регистратор эмиссии кодов или подключить к нему удаленный доступ. Данное устройство позволяет получать коды для новых товарных единиц ЛС.
Отдельные правила установлены для медицинских учреждений, которые не продают лекарства, а выдают их по рецептам, либо используют для лечения пациентов. Таким организациям надо использовать специальное устройство — регистратор выбытия. Это аналог онлайн-кассы. Он передает в «Честный знак» сведения о списании медикаментов. Регистраторы выбытия предоставляются бесплатно.
Видео:Маркировка Лекарственных Средств в РФ. К чему готовиться аптеке.Скачать

Как подключиться к системе маркировки лекарственных средств
Нужно совершить следующие действия.
1. Получите сертификат усиленной квалифицированной электронной подписи (УКЭП).
Получить сертификат усиленной квалифицированной электронной подписи
2. Войдите в систему «Честный знак» и нажмите «Зарегистрируйтесь».
3. Выберите тип участника (резидент РФ или иностранный резидент), сертификат УКЭП.
4. Заполните предложенные поля, в том числе данные о лицензии на медицинскую и фармацевтическую деятельность.
5. Нажмите «Зарегистрироваться», а затем во всплывающем окне — «Подписать и отправить».
6. В течение нескольких дней ждите ответа от системы (он придет на электронную почту).
7. Получив уведомление об успешно пройденной регистрации, внесите в личный кабинет перечень адресов мест осуществления деятельности.
Подробную инструкцию по регистрации можно найти на сайте «Честного знака» .
Видео:МАРКИРОВКА ЛЕКАРСТВ. Ответы экспертов SCM Pharm: логистика лекарственных средств.Скачать

Что делать с немаркированными лекарствами
В части 7.1 статьи 67 Закона № 61-ФЗ говорится, как поступить с препаратами, произведенными до 1 июля 2020 года (в отношении лекарств для семи ВЗН — до 31 декабря 2019 года). Их можно хранить, перевозить, продавать, отпускать, передавать и применять без нанесения кодов до окончания срока годности.
Видео:Маркировка лекарственных препаратовСкачать

Штрафы за лекарства без маркировки
Нарушители могут быть привлечены к административной ответственности по статье 15.12 КоАП РФ. В ней говорится, что контролеры вправе конфисковать товар и выписать штраф:
- за изготовление продукции без обязательной маркировки или с нарушением правил маркировки: для юрлица — от 50 тыс. до 100 тыс. руб.; для предпринимателя или должностного лица — от 5 тыс. до 10 тыс. руб.;
- за продажу, покупку с целью сбыта, хранение, транспортировку изделий без обязательной маркировки: для юрлица — от 50 тыс. до 300 тыс. руб.; для предпринимателя или должностного лица — от 5 тыс. до 10 тыс. руб.
Если указанные нарушения совершены в крупном размере, возможна уголовная ответственность по статье 171.1 УК РФ.
Учитывая немалый размер санкций, можно сделать следующий вывод. Для компаний и ИП гораздо выгоднее соблюдать правила маркировки лекарств, нежели платить большие штрафы.
Видео:Обязательная маркировка товара: зачем нужна и какие товары подлежат маркировкеСкачать

Маркировка лекарственных средств
В 2020 году вводится обязательная маркировка лекарственных препаратов. Рассказываем, что нужно сделать и подключить и как работать дальше.
Нет времени разбираться? Поможем!
Видео:Какие товары НЕ подлежат маркировке ? Подробнее здесьСкачать
Что вы узнаете
Видео:Маркировка лекарственных средств: как обработать поступление по обратному порядкуСкачать

Закон о маркировке лекарств
425-ФЗ от 28 декабря 2017 года вносит изменения в закон «Об обращении лекарственных средств». Он обязывает маркировать лекарства средствами идентификации, а участников оборота отчитываться в систему Мониторинга движения лекарственных препаратов (МДЛП) обо всех операциях с маркированными лекарствами.
Видео:Маркировка лекарств для аптекиСкачать
Сроки
- С 1 июля 2019 началась регистрация участников оборота на Честныйзнак.рф.
- С 1 октября 2019 введена обязательная маркировка для лекарственных препаратов из списка высокозатратных нозологий.
- С 1 июля 2020 начнется обязательная маркировка всех выпускаемых лекарств и передача сведений по ним в систему маркировки.
Специалист ЦРПТ расскажет, как работать в системе «Честный знак» с 1 июля 2020, а эксперт СБИС покажет весь процесс от приемки до продажи в СБИС.
Видео:Маркировка лекарственных средств QR-кодамиСкачать

Участники маркировки лекарств
Производители
регистрируют произведенные лекарства, отчитываются о введении нового кода в оборот.
Дистрибьюторы
регистрируют получение препарата и передачу его далее по цепочке.
Аптеки
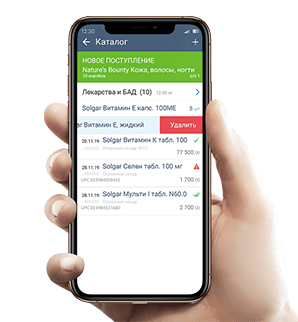
фиксируют прием препарата от дистрибьютора, продажу конечному клиенту на кассе.
Медцентры
отмечают поступление препарата от дистрибьютора, списания для оказания медуслуг.
Видео:РАВИЛЬ ГИМАДИЕВ. ВНЕДРЕНИЕ МАРКИРОВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВСкачать

Схема работы
Поставщики и ЦРПТ договорились о существовании обратной схемы маркировки – когда аптека передает коды дистрибьютору, а не наоборот.
1. Производитель получает коды в системе маркировки и размещает их на упаковках лекарств.
2. При отгрузке производитель отправляет дистрибьютору вместе с товаром список кодов с упаковок.
3. Дистрибьютор принимает товар как обычно и подтверждает получение кодов. Далее фасует товар и отправляет в аптеку.
4. Аптека при приемке сканирует коды с упаковок лекарств.
5. После отправляет коды в МДЛП поставщику для подтверждения.
6. При продаже провизор сканирует код маркировки на упаковке, оператор фискальных данных отправляет его в систему маркировки. Код выбывает из оборота.
Также поддерживается и прямой порядок, по которому поставщик отправляет поступление вместе с кодами, а аптека сверяет их и утверждает.
Видео:Маркировка лекарственных средств (ролик создан совместно с компанией STADA)Скачать

Код маркировки — что это и как выглядит?
Каждый препарат маркируют уникальным двумерным Data Matrix кодом, его наносят на упаковку с лекарством.
Общая длина ― 83 символа. В нем содержится:
- код товара: «01» + 14 символов GTIN ― международного кода маркировки
- индивидуальный серийный номер: «21» + 13 символов ― он генерируется оператором системы
- ключ проверки: «91» + 4 символа
- код проверки: «92» + 44 символа
Рекомендованный размер кода Data Matrix ― 16х16 мм. Но можно и меньшего размера ― ЦРПТ провел успешные тесты с марками 10х10 и 12х12 мм.
На большую транспортную тару (коробка, паллеты) наносят коды формата GS1 128. Такой код содержит данные обо всех упаковках внутри.
Видео:Пошаговая инструкция по приему, учету и выбытию лекарственных препаратовСкачать

Штрафы
Незарегистрированные в МДЛП организации будут оштрафованы, сумму штрафа пока не определили. Нарушителей будут выявлять без выездных проверок, а просто при сопоставлении двух баз данных – лицензирования и регистрации в системе МДЛП.
Видео:Медикаменты теперь подлежат обязательной маркировкеСкачать

Как зарегистрироваться в системе маркировки?
Для регистрации нужна усиленная квалифицированная электронная подпись на носителе Рутокен.
Установите необходимое ПО:
- операционная система Windows 7 / Mac OS X 10.8 или новее
- браузер Google Chrome, Mozilla Firefox, Opera, Internet Explorer 11, Safari
- плагин КриптоПро. Скачать
- сертифицированное СКЗИ
Если вы правильно настроили рабочее место ( см.пункт 1 ), система предложит ввести личные данные.
- Нажмите «Сертификат УКЭП» и выберите сертификат вашей электронной подписи.
- Автоматически заполнятся поля: «Субъект РФ», «Адрес электронной почты», «ИНН», «Имя» и «Фамилия».
- Заполните сведения о лицензии на медицинскую и фармацевтическую деятельность.
Видео:С нового года в России вводится обязательная маркировка лекарственных средствСкачать

Аптекам
Что нужно для маркировки
Подключение к системе маркировки, чтобы отправлять туда коды.
Обновить прошивку онлайн-кассы, чтобы добавлять код маркировки в чек.
Подключение кассы к ОФД, которые умеют передавать чеки с кодами в систему маркировки.
Оборудование для сканирования марок на кассе и на складе.
Маркировка «под ключ»
Как принимать
При приемке нужно отсканировать все коды с упаковок лекарств и отправить их в систему маркировки и поставщику для подтверждения.
Если работаете в СБИС, то после сканирования вы просто нажмете кнопку «Отправить коды», и данные автоматически зарегистрируются в МДЛП и передадутся поставщику.
Как продавать
Продавать маркированные лекарства нужно через онлайн-кассу с ОФД: провизор сканирует код с упаковки, товар добавится в чек, а оператор фискальных данных отправит его в систему маркировки. Если марки нет – фармацевт сканирует штрихкод, и продает лекарство как раньше.
Приложение на ваш смартфон
Для небольших складов
Просто установите на него приложение СБИС Доки.
+ работает без привязки к компьютеру
+ сразу видно результаты проверки
— небольшая скорость сканирования
2D-cканер от 3 100 ₽
Для средних складов
+ высокая скорость сканирования
— работа только с компьютером
— ограниченная дальность действия
Терминал сбора данных от 22 850 ₽
Для больших складов
+ работает без привязки к компьютеру
+ высокая скорость сканирования
Видео:В России вводят обязательную маркировку лекарствСкачать

Дистрибьюторам
При обратном порядке акцептования дистрибьютору нужно только подтвердить коды, полученные от аптеки. Если вы работаете в СБИС, то вам даже этого делать не нужно. Сервис сам получит коды от аптек, автоматически подтвердит их и отправит в МДЛП – вы будете оформлять документы, как обычно.
Подключим к системе маркировки
Видео:МАРКИРУЕМ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫСкачать

Стоматологиям и медцентрам
Что нужно для маркировки
Подключение к системе маркировки, чтобы отправлять туда коды.
2D-сканер для проверки марок и приемки лекарств от поставщика.
Регистратор выбытия — устройство, фиксирующее выбытие маркированного лекарства из оборота при выдаче пациенту.
Как принимать
Маркировка лекарств в стоматологии, больнице и медицинском центре с точки зрения приемки ничем не отличается от аптек — сканируем коды с упаковок лекарств, передаем данные в МДЛП и поставщику.
Как списывать
Медицинские учреждения, которые используют препараты для оказания медицинских услуг, списывают лекарства с помощью регистратора выбытия. Перед вскрытием упаковки сканируем код с упаковки, и данные отправятся в МДЛП.
Как получить регистратор выбытия?
Регистратор получают бесплатно в ЦРПТ. Для этого в личном кабинете Честного знака необходимо оформить заявку и договор по инструкции. Наши специалисты могут помочь оформить необходимые документы — звоните.
Обязательная маркировка лекарств в 2020 году: руководство для участников оборота
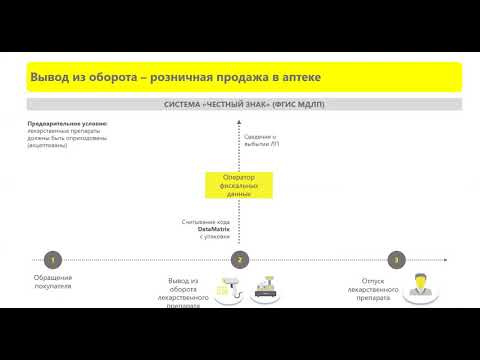
Для маркировки лекарств используется система автоматизированного учёта и мониторинга движения лекарственных препаратов медицинского назначения (МДЛП). Она дополняет государственную регистрацию и экспертизу лекарств, позволяя отслеживать все этапы их оборота — от производителя до конечного потребителя. Основная цель внедрения системы — борьба с контрафактной продукцией.
МДЛП создавалась и развивалась в несколько этапов:
- 1 февраля 2017 года — начало эксперимента и создание системы под контролем Минздрава, Росздравнадзора, Минпромторга и ФНС.
- 1 ноября 2018 года — переход системы МДЛП к оператору Центр развития перспективных технологий (Оператор-ЦРПТ) и её включение в единую национальную систему маркировки и прослеживаемости товаров Честный ЗНАК.
- 1 июля 2019 года — начало регистрации аптек и медицинских учреждений в системе МДЛП для работы с препаратами из перечня высокозатратных нозологий.
- 1 октября 2019 года — начало обязательной маркировки первой категории лекарств — препаратов из перечня федеральной программы «Семь высокозатратных нозологий» (7ВЗН).
- 1 января 2020 года — плановый срок начала обязательной маркировки всех лекарственных препаратов (перенесён из-за неготовности участников оборота).
- 1 июля 2020 года — начало обязательной маркировки лекарств с массовым запуском системы мониторинга.
Какие нормативно-правовые акты регулируют маркировку лекарств
Поскольку проект по маркировке лекарственных препаратов реализуется на протяжении уже нескольких лет, нормативная база создавалась постепенно. На сегодняшний день она представлена:
- Федеральным законом «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ в последней редакции.
- Постановлением Правительства РФ от 24 января 2017 г. № 62 «О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» с изменениями и дополнениями от 30.12.2017, 28.08.2018 и 07.08.2019.
- Постановлением Правительства РФ от 14 декабря 2018 г. № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» с изменениями и дополнениями от 30.08.2019.
- Постановлением Правительства РФ от 14 декабря 2018 г. № 1557 «Об особенностях внедрения системы мониторинга движения лекарственных препаратов для медицинского применения».
- Постановлением Правительства РФ от 14 декабря 2018 г. № 1558 «Об утверждении Правил размещения общедоступной информации, содержащейся в системе мониторинга движения лекарственных препаратов для медицинского применения, в информационно-телекоммуникационной сети „Интернет“ (в том числе в форме открытых данных)».
- Постановлением Правительства РФ от 8 мая 2019 г. № 577 «Об утверждении размера платы за оказание услуг по предоставлению кодов маркировки, необходимых для формирования средств идентификации и обеспечения мониторинга движения товаров, подлежащих обязательной маркировке средствами идентификации, а также о порядке её взимания».
Как работает ФГИС МДЛП
В системе регистрируются участники оборота лекарственных препаратов медицинского назначения:
- производители;
- дистрибьюторы и логистические компании;
- аптеки;
- медицинские организации.
До 1 июля 2020 года любой из участников рынка мог добровольно зарегистрироваться в системе и принять участие в эксперименте по маркировке. При этом все основные расходы покрывались оператором системы, участники могли постепенно тестировать новые бизнес-процессы и внедрять их в свою деятельность.
С 1 июля 2020 года обязанность по маркировке лекарственных препаратов распространится на все лекарства и всех участников оборота.
Оборот немаркированных лекарств с 1 июля 2020 года будет запрещён, за исключением:
- препаратов, произведённых до 1 июля 2020 года;
- препаратов, произведённых до 31 декабря 2019 года и предназначенных для обеспечения больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, а также для обеспечения лиц после трансплантации органов и (или) тканей.
Указанные выше лекарства можно реализовывать, хранить и применять до истечения срока годности.
Для каждого участника в системе МДЛП создаётся свой личный кабинет и предусмотрен свой набор действий по регистрации, направлению сведений в систему и информационному взаимодействию.
Общая схема работы в системе МДЛП:
- Зарегистрированные в системе производители наносят на каждую упаковку лекарственного препарата уникальный идентификационный код — DataMatrix. Код запрашивается у оператора системы через регистратор эмиссии и выдаётся системой. Он наносится на потребительскую (вторичную) упаковку, а если её нет — на первичную упаковку. Сведения о маркировке производители направляют в систему МДЛП.
- Дистрибьюторы, логистические компании и аптеки считывают код с каждого товара и передают в систему сведения о полученных и реализованных лекарственных препаратах.
- Аптеки, осуществляющие бесплатную выдачу лекарств по рецептам, и медицинские организации передают через регистратор выбытия в систему сведения о расходе лекарственных препаратов.
Каким требованиям должны отвечать участники оборота лекарственных препаратов
Маркировка не отменяет обязанностей участников оборота, связанных с экспертизой и государственной регистрацией лекарственных препаратов, как и в целом требований, предъявляемых к участникам рынка в соответствии с №61-ФЗ «Об обращении лекарственных средств». Однако в связи с внедрением обязательной маркировки появился ряд новых требований — они обеспечивают возможность работы в системе МДЛП и предусматривают:
- Наличие специального оборудования и программного обеспечения.
- Регистрацию в системе, для чего нужна квалифицированная электронная подпись.
- Соблюдение установленного порядка передачи сведений в систему для регистрации, маркировки и учёта движения лекарственных препаратов.
Производители (фармацевтические компании) должны быть оснащены регистратором эмиссии — промышленным программно-аппаратным комплексом для генерации ключа и проверочного кода, а также хранения кодов маркировки. Для его получения нужно подать заявку Оператору-ЦРПТ. С производителем заключаются договоры по предоставлению регистратора эмиссии и оказанию услуг по предоставлению кодов маркировки.
Медицинские организации и аптеки, осуществляющие бесплатную реализацию маркированных лекарственных препаратов, должны быть оснащены регистраторами выбытия по количеству мест ведения деятельности. Регистратор — это аналог онлайн-кассы, только для фиксации бесплатного отпуска лекарств. Устройства поставляются Оператором-ЦРПТ, который также обеспечивает их обслуживание.
Не требуется оснащать регистратором выбытия:
- медучреждения Минобороны;
- медицинские (врачебные) кабинеты, действующие в школах, детсадах или в других организациях, при условии, что такие кабинеты входят в структуру медицинской организации;
- структурные подразделения, которые получают препараты из своей головной медицинской организации;
- аптеки (пункты, киоски), которые не реализуют препараты на бесплатной основе по рецепту.
Аптеки, которые занимаются розничной продажей лекарственных препаратов, могут ограничиться имеющимся оборудованием — онлайн-кассой и присоединённым сканером для считывания кода (2D сканер штрихкода). Если розничной продаже сопутствует выдача лекарств по льготным рецептам, нужно дополнительно оснастить аптеку регистратором выбытия.
Зарегистрированные дистрибьюторы используют имеющиеся программно-технические средства, но их обязательно необходимо интегрировать с системой МДЛП (в составе системы Честный ЗНАК).
Порядок регистрации в системе маркировки лекарств
С 1 июля 2020 года регистрацию должны пройти участники оборота лекарств, которые:
- не принимали участия в эксперименте;
- не попали под требования обязательной маркировки лекарств из перечня высокозатратных нозологий;
- только начинают свою деятельность на рынке производства и реализации лекарственных препаратов.
Для каждого из участников оборота (производитель, дистрибьютор, аптека, медучреждение) предусмотрен специфический набор действий по регистрации в системе и внедрению процессов в свою деятельность.
Все участники предварительно должны:
- Оформить усиленную квалифицированную электронную подпись (УКЭП) в одном из удостоверяющих центров, аккредитованных Минкомсвязью России. При наличии УКЭП необходимо проверить её соответствие требованиям. Она должна быть получена на имя руководителя юридического лица или на ИП, быть действующей, а указанные при оформлении сведения — точно совпадать с данными ЕГРЮЛ или ЕГРИП.
- Установить программное обеспечение и настроить его для работы с УКЭП.
- Зарегистрироваться в системе Честный ЗНАК. Первично регистрируется онлайн-заявка, после чего на электронную почту поступает информационное письмо с логином и паролем для входа в систему. Для завершения регистрации в системе нужно в течение десяти дней после подачи заявки направить в Росздравнадзор оригиналы документов.
- Заполнить профиль в личном кабинете.
- Зарегистрировать в системе места деятельности (производства), используемые на предприятии учётные системы и выпускаемые лекарственные препараты. Для регистрации лекарств обязательно указываются: GTIN товара (ЮНИСКАН ГС1 РУС), номер регистрационного удостоверения препарата и дата его регистрации.
- Установить, внедрить оборудование для взаимодействия с системой и наладить его работу. Это комплексная процедура, часть технологических и бизнес-процессов фармпроизводителя. В результате должны быть обеспечены нанесение кодов Data Matrix, их верификация, интеграция процессов с системой управления заказами (СУЗ) и системой Честный ЗНАК. Основные компоненты промышленного программно-аппаратного комплекса — регистратор эмиссии, СУЗ, интеграционное программное обеспечение.
- Протестировать работу программно-аппаратного комплекса и, если необходимо, обучить персонал.
- Зарегистрироваться в системе Честный ЗНАК, направив онлайн-заявку. По результатам рассмотрения заявки на электронную почту придёт письмо с логином и паролем для входа в систему.
- Интегрировать используемые программно-аппаратные комплексы (устройства и средства) с системой Честный ЗНАК.
- Протестировать процессы, порядок действий при приёмке лекарственных препаратов, формировании заказов и их отправке в аптечные и медицинские организации. В рамках тестирования необходимо заказать в техподдержке системы МДЛП тестовые коды и выполнить операции в тестовом контуре.
- Зарегистрироваться в системе Честный ЗНАК, направив онлайн-заявку. По результатам её рассмотрения получить логин и пароль для входа в систему.
- Обновить программное обеспечение онлайн-кассы для передачи ОФД сведений о продаже маркированных лекарств. Проверить способность имеющегося 2D сканера штрихкода считывать DataMatrix, при необходимости приобрести такой сканер.
- Получить у Оператора-ЦРПТ и установить регистраторы выбытия в количестве, соответствующем числу мест ведения деятельности согласно данным лицензии (только для аптек, осуществляющих бесплатный отпуск лекарств).
- Протестировать процессы и действия в рамках работы с системой МДЛП. Для этого в техподдержке заказываются коды и выполняются операции в тестовом контуре.
- Устранить выявленные в ходе тестирования проблемы.
Медицинские организации должны:
- Зарегистрироваться в системе Честный ЗНАК, направив онлайн-заявку. Получить логин и пароль для входа в систему.
- Получить у Оператора-ЦРПТ и установить регистраторы выбытия в количестве, соответствующем числу мест ведения деятельности согласно данным лицензии.
- Оборудовать рабочие места, установить необходимое для работы в системе программное обеспечение и оборудование, протестировать его. Программно-аппаратный комплекс включает регистратор выбытия, 2D сканер штрихкода, способный считывать DataMatrix, и медицинскую информационную систему (МИС), которая соответствует требованиям системы МДЛП. Работоспособность комплекса проверяется в тестовом контуре с помощью тестовых кодов, полученных в техподдержке системы МДЛП.
- Устранить выявленные в ходе тестирования проблемы и обучить персонал работе в системе.